
【题目】乙酰乙酸乙酯是有机合成中非常重要的原料,实验室制备乙酰乙酸乙酯的反应原理、装置示意图和有关数据如下所示:

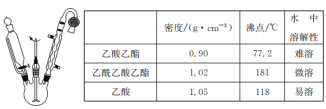
实验步骤:
Ⅰ.合成:向三颈烧瓶中加入9.8ml无水乙酸乙酯,迅速加入0.1g切细的金属钠。水浴加热反应液,缓慢回流约2h至金属钠全部反应完。停止加热,冷却后向反应混合物中加入50%乙酸至反应液呈弱酸性。
Ⅱ.分离与提纯:
①向反应混合物中加入等体积的饱和食盐水,分离得到有机层。
②水层用5mL无水乙酸乙酯萃取,分液。
③将①②所得有机层合并,洗涤、干燥、蒸馏得到乙酰乙酸乙酯粗产品。
④蒸馏粗产品得到乙酰乙酸乙酯3.9g。
(1)球形冷凝管中冷却水从______(填“上”或“下”)口进入,上方干燥管中盛无水CaCl2,其作用是________。
(2)实验室制备乙酰乙酸乙酯时,通常在无水乙酸乙酯中加入微量的无水乙醇,其作用是___。
(3)分离与提纯操作①中使用的分离仪器是________。加入饱和食盐水的作用是 _______。
(4)分离与提纯操作③用饱和NaHCO3溶液洗涤的目的是 _______。
(5)本实验的产率为_______ %(结果保留两位有效数字)。
【答案】下 防止空气中的水蒸气进入反应装置 乙醇与钠反应生成乙醇钠,乙醇钠作催化剂,加快反应速率 分液漏斗 盐析,降低乙酰乙酸乙酯在水中的溶解度,有利于分层 除去乙酸 60
【解析】
(1)冷却水从下口进,从上口出,冷凝效果较好;无水CaCl2为干燥剂,防止空气中的水蒸气进入反应装置;
(2)乙醇与钠反应生成乙醇钠;
(3)分离互不相溶且密度不同的两种液体的操作方法为分液;加入饱和食盐水的作用是盐析;
(4)饱和NaHCO3溶液与乙酸反应,结合分离提纯的思路分析;
(5)9.8mL无水乙酸乙酯的质量为:9.8mL×0.9g/mL=8.82g,根据理论上生成乙酰乙酸乙酯的质量,结合蒸馏粗产品得到乙酰乙酸乙酯3.9g可计算出本实验的产率。
(1)为增加冷凝效果,球形冷凝管的冷却水从下口进入,从上口出;上方干燥管中盛有无水CaCl2,其作用是防止空气中的水蒸气进入反应装置,
故答案为:下; 防止空气中的水蒸气进入反应装置;
(2)实验室制备乙酰乙酸乙酯时,装置中有切细的金属钠,加入微量的无水乙醇,其作用是乙醇与钠反应生成乙醇钠,乙醇钠作催化剂,加快反应速率,
故答案为:乙醇与钠反应生成乙醇钠,乙醇钠作催化剂,加快反应速率;
(3)分离互不相溶且密度不同的两种液体对应的操作为分液,使用的分离仪器是分液漏斗;加入饱和食盐水的作用是盐析,降低乙酰乙酸乙酯在水中的溶解度,有利于分层,
故答案为:分液漏斗;盐析,降低乙酰乙酸乙酯在水中的溶解度,有利于分层;
(4)混合后的有机层中含有乙酸,NaHCO3与乙酸反应生成乙酸钠溶于水,乙酸钠难溶于乙酰乙酸乙酯,分离与提纯操作③用饱和NaHCO3溶液洗涤的目的是除去乙酸,
故答案为:除去乙酸;
(5)9.8mL无水乙酸乙酯的质量为:9.8mL×0.9g/mL=8.82g,理论上生成乙酰乙酸乙酯的质量为:![]() g=6.51g,蒸馏粗产品得到乙酰乙酸乙酯3.9g,则本实验的产率为:
g=6.51g,蒸馏粗产品得到乙酰乙酸乙酯3.9g,则本实验的产率为:![]() ×100%≈60%,
×100%≈60%,
故答案为:60。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化合物M(结构式如下图)是最常用的还原剂,由H·C· Brown和 Schlesinger于1942年在芝加哥大学发现,其中X、Y、Z是原子序数依次减小的不同短周期主族元素,X与W、Z与W均能形成原子个数比为1:1和2:1的化合物,W原子的最外层电子数是电子层数的3倍,下列叙述正确的是( )
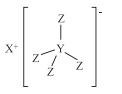
A.Y的最高价氧化物对应的水化物是一种一元弱酸
B.Z元素位于第3周期第ⅦA族
C.X和Z形成的化合物的水溶液呈酸性
D.化合物M不能与Z2W2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,4.48L 空气中所含原子数为0.2NA
B.常温常压下,2.3g NO2和N2O4的混合物中含有的氧原子数为0.2NA
C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2 NA
D.常温下,0.1 mol·L-1Na2CO3溶液中阴离子总数大于0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:①CO燃烧热为283.0kJ·mol-l,②N2(g)+O2(g) =2NO(g) △H=+180.5kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应,能消除污染,写出该反应的热化学方程式______________。
(2)某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应:
)在刚性容器内发生反应:![]() (g)+ I2(g)
(g)+ I2(g)![]()
![]() (g)+2HI(g) ΔH=+89.3 kJ·mol 1,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为____,该反应的平衡常数Kp=____Pa(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有____(填标号)。
(g)+2HI(g) ΔH=+89.3 kJ·mol 1,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为____,该反应的平衡常数Kp=____Pa(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有____(填标号)。
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度
(3)室温下,烟气中的SO2可用某浓度的NaOH溶液吸收得到pH=7的溶液,试计算所得溶液中![]() =_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
=_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
(4)烟气中的SO2也可用Na2SO3溶液吸收,吸收过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 99:1 | 1:1 | 1:99 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液呈中性时,溶液中离子浓度由小到大的顺序为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ 氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能够引起燃烧。某活动小组准备使用下列装置制备LiH固体。
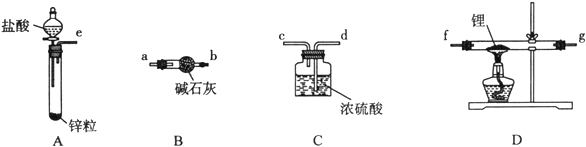
甲同学的实验方案如下:
(1)仪器的组装连接:上述仪器装置接口的连接顺序为____________________。
(2)添加药品:用镊子从试剂瓶中取出一定量金属锂(固体石蜡密封),然后在甲苯中浸洗数次,该操作的目的是_________,然后快速把锂放入到石英管中。
(3)加热一段时间后停止加热,继续通氢气冷却,然后取出LiH,装入氮封的瓶里,保存于暗处。采取上述操作的目的是为了避免LiH与空气中的水蒸气接触而发生危险。(反应方程式:LiH + H2O LiOH + H2↑),分析该反应原理,完成LiH与无水乙醇反应的化学方程式________。
(4)准确称量制得的产品0.174g,在一定条件下与足量水反应后,共收集到气体470.4 mL(已换算成标准状况),则产品中LiH与Li的物质的量之比为____________________。
(5)乙同学对甲的实验方案提出质疑,他认为未反应的H2不能直接排放所以在最后连接了装置E用来收集H2,请将E装置补充完整___________________
测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:废水中氰化钠的最高排放标准为 0.50mg/L。Ag+ + 2CN- = [Ag(CN)2]-,Ag+ + I- = AgI↓,AgI呈黄色,且CN-优先于Ag+反应。
实验如下:取30.00 mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.000×10-4 mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50 mL。滴定终点的判断方法是___________________________经计算处理后的废水中NaCN的浓度为_______________mg/L(保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究固体甲(含两种元素)和固体乙(无机矿物盐,含五种元素)的组成和性质,设计并完成了如下实验:
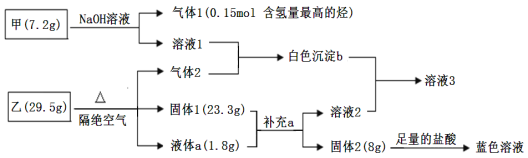
已知:向溶液1中连续滴加盐酸,先产生白色沉淀,后沉淀溶解;向溶液2中连续通入气体2,也是先产生白色沉淀,后沉淀溶解。请回答下列问题:
(1)甲的化学式____________,乙的化学式______________。
(2)加热条件下,气体1与固体2反应,产物中有一种气体和一种固体,该反应的化学方程式为__________________。
(3)气体2与足量溶液1反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂一空气电池具有能量密度高的优点,有望成为新能源汽车的电源,其结构如图所示,其中固体电解质只允许![]() 通过。
通过。
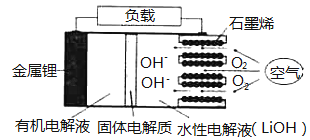
下列说法正确的是 ( )
A.放电时,负极反应式:![]()
B.放电时,当外电路中有![]() 转移时,水性电解液离子总数增加
转移时,水性电解液离子总数增加![]()
C.应用该电池电镀铜,阴极质量增加64g,理沦上将消耗![]()
D.若把水性电解液换成固体氧化物电解质,则易引起正极材料碳孔堵塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g),下列证据能说明反应一定达到化学平衡状态的是
2SO3(g),下列证据能说明反应一定达到化学平衡状态的是
A.容器内的压强不再改变B.c(SO2):c(O2):c(SO3)=2:1:2
C.混合气体的密度不再改变D.SO2的生成速率与SO3的消耗速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物是化工、能源、环保等领域的研究热点。回答下列问题:
(1)N2O在金粉表面发生热分解反应:2N2O(g)![]() 2N2(g)+O2(g) H
2N2(g)+O2(g) H
己知:4NH3(g)+3O2(g)=2N2(g)+6H2O(l) H1
2NH3(g)+3N2O(g)=4N2(g)+3H2O(l) H2
H=____(用含H1、H2的代数式表示)。
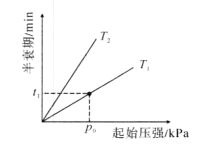
(2)一氧化二氮可反生2N2O(g)![]() 2N2(g)+O2(g)。不同温度(T),N2O分解半哀期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___T2(填“>”、“=”或“<”)。当温度为T1、起始压强为P0,反应至t1min时,体系压强P=____(用P0表示)。
2N2(g)+O2(g)。不同温度(T),N2O分解半哀期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___T2(填“>”、“=”或“<”)。当温度为T1、起始压强为P0,反应至t1min时,体系压强P=____(用P0表示)。
(3)将NH3与O2按体积比4:5充入刚性容器中,起始体系总压强为P0kPa,分别在催化剂M、N作用下发生反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g) H3=-905.0kJ/mol,NH3的分压(P)与时间和温度的关系如图所示:
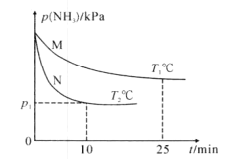
①催化剂的催化效果:M____N(填“强于”或“弱于”)。
②T°C时,0~12.5min内P(NH3)减小量___(填“>”、“=”或“<”)12.5~25min内P(NH3)减小量,理由为___。
(4)NaClO2是一种绿色消毒剂和漂白剂,工业上采用电解法制备NaClO2的原理如图所示。
①交换膜应选用___(填“阳离子交换膜”或“阴离子交换膜”)。
②阳极的电极反应式为_____。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com