
【题目】臭氧是理想的烟气脱硝试剂,其脱硝反应为:2NO2(g)+O3(g)N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
A | B | C | D |
|
|
|
|
t1时仅加入催化剂,平衡向正方向移动 | 达平衡时,仅改变x,则x为c(O2) | 从反应开始达平衡气体浓度变化 | 升高温度,平衡常数减小 |
A.AB.BC.CD.D
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO2(红棕色)![]() N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )
N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )

A.b点的操作是拉伸注射器
B.d点:v(正) > v(逆)
C.c点与a点相比,c(NO2)增大,c(N2O4)减小
D.若不忽略体系温度变化,且没有能量损失,则温度T(c) > T(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家提出如下光分解法制备氢气:
①2Ce4+(aq)+H2O(l)===2Ce3+(aq)+![]() O2(g)+2H+(aq) ΔH1
O2(g)+2H+(aq) ΔH1
②Ce3+(aq)+H2O(l)===Ce4+(aq)+![]() H2(g)+OH-(aq) ΔH2
H2(g)+OH-(aq) ΔH2
③H2O(l)===H+(aq)+OH-(aq) ΔH3
④2H2O(l)===2H2(g)+O2(g) ΔH4
下列说法正确的是( )
A. Ce4+能够增大水分解反应的活化能,提高反应速率
B. Ce3+是反应②和反应③的催化剂
C. 上述反应中,ΔH4=2ΔH1+4ΔH2-4ΔH3
D. 通常条件下,反应④中生成H2、O2的速率之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日常生活中最常见的塑化剂是邻苯二甲酸二丁酯,它可由邻苯二甲酸酐与正丁醇在浓硫酸共热下反应制得,反应的化学方程式为:

装置图(部分装置省略)如下:

已知:正丁醇沸点118℃,纯邻苯二甲酸二丁酯(分子量278)是无色透明、具有芳香气味的油状液体,沸点340℃,温度超过180℃时易发生分解。
由邻苯二甲酸酐、正丁醇制备邻苯二甲酸二丁酯实验操作流程如下:
①向三颈烧瓶内加入22.5g(0.15mol)邻苯二甲酸酐,14.8g(0.2mol)正丁醇以及少量浓硫酸。
②搅拌,升温至105℃,持续搅拌反应2小时,保温至反应结束。
③冷却至室温,将反应混合物倒出。混合物先经过碳酸钠溶液洗,再水洗,得到粗产品。
④粗产品用无水氯化钙干燥,静置后取清液进行减压蒸馏,最后处理得到产品20.85g。
请回答以下问题:
(1)步骤②中不断从分水器下端分离出产物水的目的是:______________。
(2)步骤③反应完混合物分离过程中,应先用5% Na2CO3溶液洗涤,其作用的作用是_____________;Na2CO3溶液浓度不宜过高,更不能使用氢氧化钠,其原因是:______________。
(3)“碳酸钠溶液洗、水洗”操作时需要使用的主要玻璃仪器有____________________。
(4)有机实验中,温度的调控尤为重要,步骤②中温度控制在105℃,其目的是_____________________;
(5)本实验中,邻苯二甲酸二丁酯的产率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电动汽车常用电池为钴酸锂电池,工作时原理如图,N极材料是金属锂和碳的复合材料,电解质为一种能传导Li+的固体电解质,电池反应式:
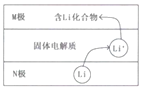
LixC6+Li1-xCoO2![]() C6+LiCoO2.下列说法错误的是( )
C6+LiCoO2.下列说法错误的是( )
A.放电时电子从N极流向M极
B.放电时N电极的反应式为:LixC6-xe-=xLi++C6
C.M极的物质具有较强还原性
D.相对于传统铅蓄电池,锂电池的比能量较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理处理燃气中的H2S,不仅可减少对大气的污染,还可进行资源化利用。回答下列问题:
(1)H2S和S的燃烧热如表所示,
物质 | 燃烧热/△H(kJmol-1) |
H2S | -a |
S | -b |
请写出常温下H2S与SO2反应的热化学方程式______。
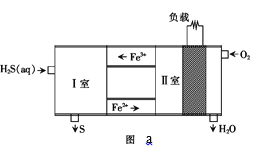
(2)可以把H2S设计为一种燃料电池,原理如图a所示:其中,Fe2+在电池工作中的作用是______;请写出 I室发生的离子方程式______。
(3)为探究H2S的直接热解2H2S(g)=2H2(g )+S2(g)。在一体积为2L的密闭容器中充入2 mol H2S与1 molAr (起到稀释作用),进行实验。
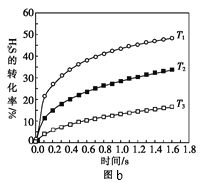
①某同学测出不同温度下H2S的物质的量与反应时间的图象,图b是截取该图象的中间某部分。请计算T2温度下,0-l0s内,H2S的反应速率v=______moL-1s-1;
②图b中,T1、T2、T3三个温度,最高的是______;比较A点与B点的逆反应速率的大小,vA(逆)______vB(逆)(填“>”、“<”或“=”);
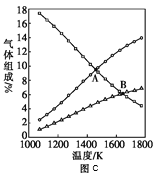
③图c是表示反应2H2S(g)=2H2(g)+S2(g)平衡时,装置内各组分气体物质的量分数=与温度的关系(其中Ar气体变化曲线未画出)。请计算:C点的平衡常数K=______;D点平衡时,H2S的转化率=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
I.(1)已知:一定条件下![]() 可被甲烷还原“纳米级”的金属铁。其反应为:
可被甲烷还原“纳米级”的金属铁。其反应为:
![]()
①此反应的化学平衡常数表达式为______
②在容积均为VL的I、II、III三个相同密闭容器中加入足量![]() ,然后分别充入amol
,然后分别充入amol![]() ,三个容器的反应温度分别为
,三个容器的反应温度分别为![]() 、
、![]() 、
、![]() 且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时
且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时![]() 的体积分数如图1所示,此时I、II、III三个容器中一定处于化学平衡状态的是______;上述反应的
的体积分数如图1所示,此时I、II、III三个容器中一定处于化学平衡状态的是______;上述反应的![]() ______
______![]() 填“大于”或“小于”
填“大于”或“小于”![]() ,该反应在______
,该反应在______![]() 填“高温”、“低温”或“任意温度”
填“高温”、“低温”或“任意温度”![]() 下可自发进行。
下可自发进行。
![]() 利用天然气为原料的一种工业合成氨简式流程图如图2:
利用天然气为原料的一种工业合成氨简式流程图如图2:
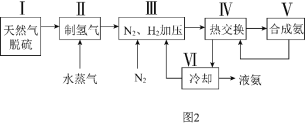
(1)步骤Ⅱ中制氢气的原理如下:Ⅰ![]() ;
;![]()
Ⅱ![]() ;
;![]()
①对于反应Ⅰ,在一定温度下的恒容容器中,表示其已达到最大化学反应限度的叙述正确的是______。
A.单位时间内1mol![]() 消耗,同时有3mol
消耗,同时有3mol![]() 生成;
生成;
B.![]() 、
、![]() 、CO的物质的量浓度相等;
、CO的物质的量浓度相等;
C.混合气体的密度再改变;
D.混合气体的压强不再改变。
②则反应![]() ;
;![]() ______
______![]() 用含
用含![]() 、
、![]() 的代数式表示
的代数式表示![]() 。
。
(2)合成氨是人类科学技术上的一项重大突破,反应原理为:![]() 在容积为10L的密闭容器中进行,起始时充入
在容积为10L的密闭容器中进行,起始时充入![]()
![]() 、
、![]()
![]() 反应在不同条件下进行,反应体系总压强随时间的变化如图3所示。
反应在不同条件下进行,反应体系总压强随时间的变化如图3所示。
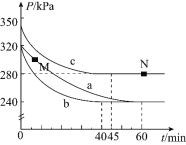
①实验a从开始至平衡时的反应速率![]() ______;实验c中
______;实验c中![]() 的平衡转化率
的平衡转化率![]() 为______。
为______。
②与实验a相比,其他两组改变的实验条件是:b______,c______。
③M点的逆反应速率![]() ______N点的正反应速率
______N点的正反应速率![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ;N点时再加入一定量
;N点时再加入一定量![]() ,平衡后
,平衡后![]() 的体积分数______
的体积分数______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,7.8g乙炔和苯的混合物中含C—H键数目为0.6NA
B.10g46%的乙醇溶液中,含H—O键的数目为0.1NA
C.1L0.1mol·L1 FeCl3溶液中含Fe3+数目为0.1NA
D.将1molNH3通入足量水中,NH3 ·H2O、NH4+ 粒子数目之和为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com