
【题目】某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。

可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应![]()
(1)装置①中发生反应的化学方程式是__________
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品,打开弹簧夹通入_________气体(填化学式)一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内。
(3)实验应避免有害气体排放到空气中,装置③中盛放的药品是_________;装置⑥中盛放的药品是_________。
(4)装置②中盛放的药品是_________;该装置的作用是_______________________。
(5)该小组得出的结论所依据的试验现象是__________________________________。
【答案】 Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O CO2 3mol·L-1稀硝酸 氢氧化钠溶液 水 将NO2转化为NO或3NO2+H2O=2HNO3+NO 装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色
【解析】(1)装置①中是铜与浓硝酸反应生成硝酸铜、二氧化氮和水,发生反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;(2)由于装置中残存的空气,能氧化NO而对实验产生干扰,所以滴加浓硝酸之前需要通入一段时间CO2赶走装置中的空气,则实验的具体操作是:滴加浓硝酸之前的操作是检验装置的气密性,加入药品,打开弹簧夹通入CO2气体一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内;(3)实验应避免有害气体排放到空气中,装置③中盛放3mol·L-1稀硝酸验证稀硝酸不能氧化一氧化氮;装置⑥中盛放氢氧化钠溶液吸收二氧化氮防止污染大气;(4)装置②中盛放的药品是水;该装置的作用是将NO2转化为NO,即3NO2+H2O=2HNO3+NO;(5)该小组得出的结论所依据的试验现象是装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色。


科目:高中化学 来源: 题型:
【题目】已知在密闭容器中反应A(g)+3B(g)2C(g) 在一定温度下达到平衡,
(1)在平衡时测得各物质的物质的量分别为n(A)=1.0mol、n(B)=0.4mol、n(C)=0.4mol,此时容器体积为2L,则此条件下的平衡常数K= .
(2)若保持温度和压强不变,在(1)中平衡中向上述容器中通入0.36mol A (g),平衡将(填“正向”、“逆向”或“不”)移动,用简要的计算过程说明理由 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素X、Y、Z、W的相对位置如表,元素X的原子核外电子数是Z的2倍。下列说法不正确的是
![]()
A. W元素的简单气态氢化物的热稳定性比Z元素的简单气态氢化物的高
B. 气体分子(ZW)2的结构式为N≡C—C≡N
C. X、Y、W三种元素的简单离子半径最大的是Y
D. 元素X可在元素W单质中燃烧。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A.NH4Cl溶液呈酸性,可用于去除铁锈
B.SO2具有还原性,可用于漂白纸张
C.Al2O3是两性氧化物,可用作耐高温材料
D.Na2SiO3溶液呈碱性,可用作木材防火剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯酚是一种重要的化工原料.以苯酚为主要起始原料,经下列反应可制得香料M和高分子化合物N.(部分产物及反应条件已略去)
(1)由苯酚生成A的化学方程式是 .
(2)已知C的分子式为C5H12O,C能与金属Na反应,C的一氯代物有2种,与C含有相同官能团的同分异构共有种,C的结构简式是;
(3)B与C反应的化学方程式是 .
(4)由苯酚生成D的化学方程式是由D生成N的反应类型是
(5)以苯酚为基础原料也可以合成防腐剂F.经质谱分析F的相对分子质量为152,其中氧元素的质量分数为31%,F完全燃烧只生成CO2和H2O.则F的分子式是 . 已知:①芳香族化合物F能与NaHCO3溶液反应,且不能发生水解反应;
②F的核磁共振氢谱显示其分子中含有4种氢原子;
③分子结构中不存在“﹣O﹣O﹣”的连接方式.F的结构简式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下图所示元素周期表中全部是金属元素的区域为___________
A.A B.B C.C D.D

(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。______________
②甲、乙两元素相比较,金属性较强的是_________(填名称),可以验证该结论的实验是_______。
A.将在空气中放置很久的这两种元素的块状单质分别放入热水中
B.将这两元素的单质粉末分别和同浓度的盐酸反应
C.将这两元素的单质粉末分别和热水作用,并滴入酚酞
D.比较这两种元素的气态氢化物的稳定性
(3)上表中所列某些元素间能形成等电子的A、B、C、D、E五种微粒,A与C组成元素相同,B、E、D组成元素相同,它们间能发生如下反应:A+B=C+D,E+B=2D,则写出B的电子式:______,比较C、B、D结合氢离子的能力由强到弱的顺序为_________________(用化学式表示)。
(4)上表中c、h元素形成的简单离子半径之比________ 1(填〉或〈或 =)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2A(g)+3B(g)4C(g)+D(g),已知起始浓度c(A)=4molmol﹣1 , c(B)=3molmol﹣1 , C、D浓度均等于0,反应开始2秒后达到平衡状态,此时D的平衡浓度为0.5molL﹣1 , 则下列说法不正确的是( )
A.反应速率v(C)=1molL﹣1s﹣1
B.C的平衡浓度为4 molL﹣1
C.A的转化率为25%
D.B的平衡浓度为1.5 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是一种重要的有色金属,近年来用途越来越广泛.请回答下列问题:
(1)下列四种化合物中含铜量最高的是(填字母)
A.Cu5FeS4
B.CuFeS2
C.Cu2S
D.Cu2(OH)2CO3
(2)2014年我国精炼铜产量796万吨,若全部由含Cu2S质量分数为32%的铜矿石冶炼得到,则需要铜矿石质量为万吨.(保留一位小数)
(3)可溶性铜盐常用于生产其它含铜化合物.在KOH溶液中加入一定量的CuSO4溶液,再加入一定量的还原剂﹣﹣肼(N2H4),加热并保持温度在90℃,生成一种对环境无污染的气体,反应完全后,分离,洗涤,真空干燥得到纳米氧化亚铜固体(Cu2O).①该制备过程的反应方程式为 .
②工业上常用的固液分离设备有(填字母)
A.离心机 B.分馏塔 C.框式压滤机 D.反应釜
(4)我国出土的青铜器工艺精湛,具有很高的艺术价值和历史价值.但出土的青铜器大多受到环境腐蚀.如图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图: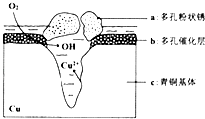
①腐蚀过程中,负极是(填“a”“b”或“c”),正极反应方程式为 .
②环境中的Cl﹣扩散到孔口,并与正极产物和负极产物生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对含有Al3+的未知溶液进行了如下分析:
(1)滴加少量NaOH溶液,无明显变化;
(2)继续滴加NaOH溶液,有白色胶状沉淀生成;
(3)滴加过量的NaOH溶液,白色胶状沉淀明显减少。
实验小组经定量分析,得出如图所示沉淀的物质的量与滴加NaOH溶液体积的关系。下列说法错误的是 ( )
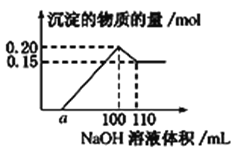
A. 该未知溶液中至少含有3种阳离子
B. NaOH溶液的物质的量浓度为5 mol·L-1
C. 若另一种离子为二价阳离子,则a=40
D. 若将最终沉淀过滤、洗涤、灼烧,其质量可能为6 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com