
【题目】已知在密闭容器中反应A(g)+3B(g)2C(g) 在一定温度下达到平衡,
(1)在平衡时测得各物质的物质的量分别为n(A)=1.0mol、n(B)=0.4mol、n(C)=0.4mol,此时容器体积为2L,则此条件下的平衡常数K= .
(2)若保持温度和压强不变,在(1)中平衡中向上述容器中通入0.36mol A (g),平衡将(填“正向”、“逆向”或“不”)移动,用简要的计算过程说明理由 .
【答案】
(1)10
(2)逆向;恒温恒压下,气体的物质的量与体积成正比,加入0.36molA时,容器体积= ![]() =2.4L,此时各物质浓度:c(A)=
=2.4L,此时各物质浓度:c(A)= ![]() =
= ![]() mol/L、c(B)=c(C)=
mol/L、c(B)=c(C)= ![]() mol/L=
mol/L= ![]() mol/L,浓度商=
mol/L,浓度商= ![]() =10.9>K,平衡逆向移动
=10.9>K,平衡逆向移动
【解析】解:(1)该时刻c(A)= ![]() =0.5mol/L、c(B)=
=0.5mol/L、c(B)= ![]() =0.2mol/L、c(C)=
=0.2mol/L、c(C)= ![]() =0.2mol/L,
=0.2mol/L,
化学平衡常数K= ![]() ,
,
所以答案是:10;(2)恒温恒压下,气体的物质的量与体积成正比,加入0.36molA时,容器体积= ![]() =2.4L,此时各物质浓度:c(A)=
=2.4L,此时各物质浓度:c(A)= ![]() =
= ![]() mol/L、c(B)=c(C)=
mol/L、c(B)=c(C)= ![]() mol/L=
mol/L= ![]() mol/L,浓度商=
mol/L,浓度商= ![]() =10.9>K,平衡逆向移动,
=10.9>K,平衡逆向移动,
所以答案是:逆向;恒温恒压下,气体的物质的量与体积成正比,加入0.36molA时,容器体积= ![]() =2.4L,此时各物质浓度:c(A)=
=2.4L,此时各物质浓度:c(A)= ![]() =
= ![]() mol/L、c(B)=c(C)=
mol/L、c(B)=c(C)= ![]() mol/L=
mol/L= ![]() mol/L,浓度商=
mol/L,浓度商= ![]() =10.9>K,平衡逆向移动.
=10.9>K,平衡逆向移动.
【考点精析】本题主要考查了化学平衡的计算的相关知识点,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】利用下列实验装置及药品能完成相应实验的是( )
A. 如图用于证明非金属性强弱:Cl>C>S
如图用于证明非金属性强弱:Cl>C>S
B. 如图用于分离I2和NH4Cl
如图用于分离I2和NH4Cl
C. 如图用于测定某NaOH溶液的浓度
如图用于测定某NaOH溶液的浓度
D.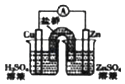 如装置能组成Cu﹣Zn原电池
如装置能组成Cu﹣Zn原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,能证明SiO2是酸性氧化物的是
①SiO2+4HF===SiF4↑+2H2O
②SiO2+CaO![]() CaSiO3
CaSiO3
③SiO2+2NaOH===Na2SiO3+H2O
④SiO2+2C![]() Si+2CO↑
Si+2CO↑
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.纸层析是色谱分析法的一种,可用于分离结构相近、性质相差较明显的物质
B.电解精炼、结晶、加热等方法是分离、提纯固体样品的基本方法
C.用玻璃棒搅动或投入几粒晶体是破坏溶液发生过饱和现象的常用方法
D.吸滤仅仅能加快过滤速度和得到更干燥的沉淀,但不能使沉淀颗粒变粗变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:在B水槽中装有500 mL水,容积为VL的试管A充满了NO2和NO的混合气体(标准状况),将试管A倒插入B水槽的水中。充 分反应后,试管A中余下气体的体积为0.6VL。

(1)将A倒插入B槽中发生的反应的化学方程为_________________,该反应中氧化剂与还原剂的质量比为________,原混合气体中NO2和NO的物质 的量之比为________。
(2)通过导气管C向余下0.6VL气体的试管A中持续通入氧气,A中可能观察到的现象是_________________________________
(3)当试管A中充满气体时停止通入氧气,然后将试管取出水槽,水槽B中溶液的物质的量浓度为________ mol·L-1(设溶液的体积仍为500 mL)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将少量氯水加入KI溶液中振荡,再加入CCl4,振荡,静置后观察到的现象是
A. 形成均匀的紫色溶液B. 有紫色沉淀析出
C. 液体分层,上层呈紫红色D. 液体分层,下层呈紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活、科研密切相关,下列有关说法不正确的是
A.含4%硅的硅钢导磁性很强,主要用作变压器的铁芯。
B.把石灰浆喷涂在树干上可消灭树皮上的过冬虫卵
C.煤焦油干馏可获得苯、二甲苯等有机物。
D.臭氧是一种有鱼腥味、氧化性极强的淡蓝色气体,可用作自来水消毒剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。

可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应![]()
(1)装置①中发生反应的化学方程式是__________
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品,打开弹簧夹通入_________气体(填化学式)一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内。
(3)实验应避免有害气体排放到空气中,装置③中盛放的药品是_________;装置⑥中盛放的药品是_________。
(4)装置②中盛放的药品是_________;该装置的作用是_______________________。
(5)该小组得出的结论所依据的试验现象是__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com