
【题目】化学与人类生产、生活、科研密切相关,下列有关说法不正确的是
A.含4%硅的硅钢导磁性很强,主要用作变压器的铁芯。
B.把石灰浆喷涂在树干上可消灭树皮上的过冬虫卵
C.煤焦油干馏可获得苯、二甲苯等有机物。
D.臭氧是一种有鱼腥味、氧化性极强的淡蓝色气体,可用作自来水消毒剂。
科目:高中化学 来源: 题型:
【题目】氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)2NH3(g)△H.
(1)已知每破坏1mol有关化学键需要的能量如表:
H﹣H | N﹣H | N﹣N | N |
435.9KJ | 390.8KJ | 192.8KJ | 945.8KJ |
则△H= .
(2)在恒温、恒压容器中,氨体积比1:3加入N2和H2进行合成氨反应,达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将(填“增大”“减小”或“不变”)
(3)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示. 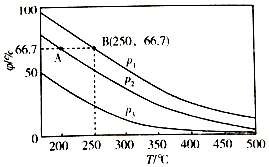
①其中,p1、p2和p3由大到小的顺序是 , 其原因是 .
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)vB(N2)(填“>”“<”或“=”)
③若在250℃、p1条件下,反应达到平衡时容器的体积为1L,则该条件下合成氨的平衡常数K=(保留一位小数).
(4)H2NCOONH4是工业由氨气合成尿素的中间产物.在一定温度下、体积不变的密闭容器中发生反应:H2NCOONH4(s)2NH3(g)+CO2(g),能说明该反应达到平衡状态的是(填序号). ①混合气体的压强不变
②混合气体的密度不变
③混合气体的总物质的量不变
④混合气体的平均相对分子质量不变
⑤NH3的体积分数不变.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在密闭容器中反应A(g)+3B(g)2C(g) 在一定温度下达到平衡,
(1)在平衡时测得各物质的物质的量分别为n(A)=1.0mol、n(B)=0.4mol、n(C)=0.4mol,此时容器体积为2L,则此条件下的平衡常数K= .
(2)若保持温度和压强不变,在(1)中平衡中向上述容器中通入0.36mol A (g),平衡将(填“正向”、“逆向”或“不”)移动,用简要的计算过程说明理由 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。
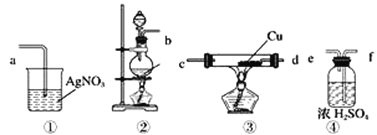
(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__。
(2)实验室制备Cl2的离子方程式为__。
(3)装置③中Cu的作用__ (用化学方程式表示)。
(4)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__。
(5)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到_____的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】屠呦呦因对青蒿素的研究而获得诺贝尔生理学或医学奖,青蒿素可以青蒿酸(结构简式如图所示)为原料合成,下列关于青蒿酸的说法中正确的是( ) 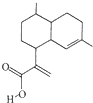
A.分子式为C15H24O2
B.属子芳香族化合物
C.能发生取代反应和加成反应
D.分子中所有原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素X、Y、Z、W的相对位置如表,元素X的原子核外电子数是Z的2倍。下列说法不正确的是
![]()
A. W元素的简单气态氢化物的热稳定性比Z元素的简单气态氢化物的高
B. 气体分子(ZW)2的结构式为N≡C—C≡N
C. X、Y、W三种元素的简单离子半径最大的是Y
D. 元素X可在元素W单质中燃烧。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A.NH4Cl溶液呈酸性,可用于去除铁锈
B.SO2具有还原性,可用于漂白纸张
C.Al2O3是两性氧化物,可用作耐高温材料
D.Na2SiO3溶液呈碱性,可用作木材防火剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是一种重要的有色金属,近年来用途越来越广泛.请回答下列问题:
(1)下列四种化合物中含铜量最高的是(填字母)
A.Cu5FeS4
B.CuFeS2
C.Cu2S
D.Cu2(OH)2CO3
(2)2014年我国精炼铜产量796万吨,若全部由含Cu2S质量分数为32%的铜矿石冶炼得到,则需要铜矿石质量为万吨.(保留一位小数)
(3)可溶性铜盐常用于生产其它含铜化合物.在KOH溶液中加入一定量的CuSO4溶液,再加入一定量的还原剂﹣﹣肼(N2H4),加热并保持温度在90℃,生成一种对环境无污染的气体,反应完全后,分离,洗涤,真空干燥得到纳米氧化亚铜固体(Cu2O).①该制备过程的反应方程式为 .
②工业上常用的固液分离设备有(填字母)
A.离心机 B.分馏塔 C.框式压滤机 D.反应釜
(4)我国出土的青铜器工艺精湛,具有很高的艺术价值和历史价值.但出土的青铜器大多受到环境腐蚀.如图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图: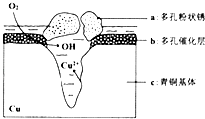
①腐蚀过程中,负极是(填“a”“b”或“c”),正极反应方程式为 .
②环境中的Cl﹣扩散到孔口,并与正极产物和负极产物生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com