
【题目】氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)2NH3(g)△H.
(1)已知每破坏1mol有关化学键需要的能量如表:
H﹣H | N﹣H | N﹣N | N |
435.9KJ | 390.8KJ | 192.8KJ | 945.8KJ |
则△H= .
(2)在恒温、恒压容器中,氨体积比1:3加入N2和H2进行合成氨反应,达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将(填“增大”“减小”或“不变”)
(3)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示. 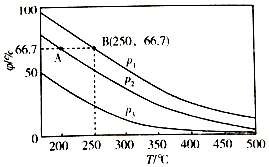
①其中,p1、p2和p3由大到小的顺序是 , 其原因是 .
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)vB(N2)(填“>”“<”或“=”)
③若在250℃、p1条件下,反应达到平衡时容器的体积为1L,则该条件下合成氨的平衡常数K=(保留一位小数).
(4)H2NCOONH4是工业由氨气合成尿素的中间产物.在一定温度下、体积不变的密闭容器中发生反应:H2NCOONH4(s)2NH3(g)+CO2(g),能说明该反应达到平衡状态的是(填序号). ①混合气体的压强不变
②混合气体的密度不变
③混合气体的总物质的量不变
④混合气体的平均相对分子质量不变
⑤NH3的体积分数不变.
【答案】
(1)﹣91.3KJ/mol
(2)不变
(3)p1>p2>p3;温度相同时,加压平衡正向移动,故压强越大平衡混合物中氨的体积分数越大;<;5925.9L2/mol2
(4)①②③
【解析】解:(1)N2 (g)+3H2 (g)2NH3(g)△H=反应物键能和﹣生成物键能和=945.8KJ/mol+3×435.9KJ/mol﹣6×390.8KJ/mol=﹣91.3KJ/mol, 所以答案是:﹣91.3KJ/mol;(2)保持恒温恒压,达到平衡后,再向容器中充入适量氨气,在恒压条件下与原平衡状态相同,为等效平衡,平衡时两种情况平衡状态相同,各物质的含量不变,所以达到新平衡时,c(H2)将不变,所以答案是:不变;(3)①由N2+3H22NH3可知,增大压强,平衡正向移动,由图象可知在相同温度下,平衡后混合物中氨的体积分数(φ)为P1>P2>P3 , 因此压强关系是P1>P2>P3 , 所以答案是:p1>p2>p3;温度相同时,加压平衡正向移动,故压强越大平衡混合物中氨的体积分数越大;②温度越大,压强越大,反应速率越大,p1>p2 , 由图可知,B对应的温度、压强大,则反应速率大,
所以答案是:<;③
N2+ | 3H2 | 2NH3 | |
起始 | 0.1 | 0.3 | 0 |
转化 | x | 3x | 2x |
平衡 | 0.1-x | 0.3-3x | 2x |
![]() =0.667,x=0.08
=0.667,x=0.08
K= ![]() =
= ![]() =5925.9L2/mol2 ,
=5925.9L2/mol2 ,
所以答案是:5925.9L2/mol2;(4)H2NCOONH4(s)2NH3(g)+CO2(g),
①该反应为气体体积增大的反应,反应过程中压强逐渐增大,当压强不变时,表明正逆反应速率相等,该反应达到平衡状态,故①正确;②由于H2NCOONH4是固体,没有达到平衡状态前,气体质量会变化,容器体积不变,密度也会发生变化,所以密度不变,达到了平衡状态,故②正确;③由于H2NCOONH4是固体,生成物全部为气体,气体的物质的量在增加,当混合气体的总物质的量不变,说明正逆反应速率相等,达到了平衡状态,故③正确;④混合气体的平均相对分子质量= ![]() ,混合气体的质量恒等于H2NCOONH4(s)分解的质量,气体的物质的量为分解的H2NCOONH4(s)的三倍,混合气体的平均相对分子质量不变恒不变,不能说明反应达到平衡状态,故④错误;
,混合气体的质量恒等于H2NCOONH4(s)分解的质量,气体的物质的量为分解的H2NCOONH4(s)的三倍,混合气体的平均相对分子质量不变恒不变,不能说明反应达到平衡状态,故④错误;
⑤因反应物(NH2COONH4)是固体物质,所以密闭容器中NH3的体积分数始终不变,故⑤错误;所以答案是:①②③.
【考点精析】认真审题,首先需要了解反应热和焓变(在化学反应中放出或吸收的热量,通常叫反应热),还要掌握化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效))的相关知识才是答题的关键.


科目:高中化学 来源: 题型:
【题目】能源可划分为一次能源和二次能源,直接从自然界取得的能源称为一次能源,一次能源经过加工、转换得到的能源称为二次能源。下列能源中属于一次能源的是( )
A.氢能B.电能C.核燃料D.水煤气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习化学应明确“从生活中来,到生活中去”的道理,请回答下列问题:
(1)漂粉精中有效成分的化学式为__________________.
(2)“硅材料”是无机非金属材料的主角,其中广泛应用于光导纤维的材料是_________.
(3)向浑浊的水中加入明矾KAl(SO4)212H2O后,水可得到净化.写出明矾在水中的电离方程式__________________,往明矾溶液中逐滴加入Ba(OH)2溶液直至Al3+恰好沉淀完全,发生反应的离子方程式为__________________.
(4)饮用水中的NO3-对人类健康产生危害,为了降低饮用水中NO3-的浓度,可以在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:
10Al+6NaNO3+4NaOH═10NaAlO2+3N2↑+2H2O.
请回答下列问题:
①在化学方程式上用单线桥标出该反应中电子转移的方向和数目:_______________
②上述反应中若生成标况下3.36LN2,则转移的电子数目为______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如图所示(部分反应条件及产物略去)。
![]()
(1)若A是一种淡黄色单质固体,则B→C的化学方程式为___________________。
(2)若A是一种黑色单质固体,将一定量C缓慢通入NaOH溶液中,充分反应,测得最后溶液的显碱性,此时溶液的溶质如果是单一成分,可能是__________、__________;如果是多种成分,可能是__________、__________。
(3)若A是一种活泼金属,C是淡黄色固体,试用化学方程式表示该物质C的一个重要应用________________________________________。 将C长期露置于空气中,最后将变成物质D,D的化学式为_____________。现有D和NaHCO3的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38g,D的质量分数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置及药品能完成相应实验的是( )
A. 如图用于证明非金属性强弱:Cl>C>S
如图用于证明非金属性强弱:Cl>C>S
B. 如图用于分离I2和NH4Cl
如图用于分离I2和NH4Cl
C. 如图用于测定某NaOH溶液的浓度
如图用于测定某NaOH溶液的浓度
D.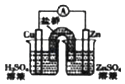 如装置能组成Cu﹣Zn原电池
如装置能组成Cu﹣Zn原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,能证明SiO2是酸性氧化物的是
①SiO2+4HF===SiF4↑+2H2O
②SiO2+CaO![]() CaSiO3
CaSiO3
③SiO2+2NaOH===Na2SiO3+H2O
④SiO2+2C![]() Si+2CO↑
Si+2CO↑
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活、科研密切相关,下列有关说法不正确的是
A.含4%硅的硅钢导磁性很强,主要用作变压器的铁芯。
B.把石灰浆喷涂在树干上可消灭树皮上的过冬虫卵
C.煤焦油干馏可获得苯、二甲苯等有机物。
D.臭氧是一种有鱼腥味、氧化性极强的淡蓝色气体,可用作自来水消毒剂。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com