
【题目】下列反应中,能证明SiO2是酸性氧化物的是
①SiO2+4HF===SiF4↑+2H2O
②SiO2+CaO![]() CaSiO3
CaSiO3
③SiO2+2NaOH===Na2SiO3+H2O
④SiO2+2C![]() Si+2CO↑
Si+2CO↑
A. ①② B. ②③ C. ③④ D. ①④
科目:高中化学 来源: 题型:
【题目】某些含磷洗涤剂含有Na5P3O10,会使水中藻类等浮游生物过量繁殖而造成水体污染。Na5P3O10中磷元素的化合价是( )
A. -2B. +1C. +4D. +5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)2NH3(g)△H.
(1)已知每破坏1mol有关化学键需要的能量如表:
H﹣H | N﹣H | N﹣N | N |
435.9KJ | 390.8KJ | 192.8KJ | 945.8KJ |
则△H= .
(2)在恒温、恒压容器中,氨体积比1:3加入N2和H2进行合成氨反应,达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将(填“增大”“减小”或“不变”)
(3)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示. 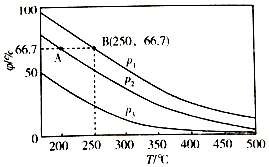
①其中,p1、p2和p3由大到小的顺序是 , 其原因是 .
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)vB(N2)(填“>”“<”或“=”)
③若在250℃、p1条件下,反应达到平衡时容器的体积为1L,则该条件下合成氨的平衡常数K=(保留一位小数).
(4)H2NCOONH4是工业由氨气合成尿素的中间产物.在一定温度下、体积不变的密闭容器中发生反应:H2NCOONH4(s)2NH3(g)+CO2(g),能说明该反应达到平衡状态的是(填序号). ①混合气体的压强不变
②混合气体的密度不变
③混合气体的总物质的量不变
④混合气体的平均相对分子质量不变
⑤NH3的体积分数不变.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色溶液中能大量共存的离子组是
A. HCO3-、Na+、OH-、K+ B. CH3COO-、Ba2+、MnO4-、H+
C. NO3-、H+、Cl-、Cu2+ D. SO42-、K+、Cl-、NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验:
Ⅰ.探究同周期元素性质的递变规律
(1)相同条件下,将钠、镁、铝各1 mol分别投入到足量的同浓度的稀盐酸中,试预测实验结果:_______与稀盐酸反应最剧烈;______与稀盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为_____________________________。
Ⅱ.探究同主族元素非金属性的递变规律
某研究性学习小组设计了一组实验来探究ⅦA族元素原子的得电子能力强弱规律。下图中A、B、C是三个可供选择制取氯气的装置,装置D的玻璃管中①、②处依次放置蘸有NaBr溶液、NaOH浓溶液的棉球。
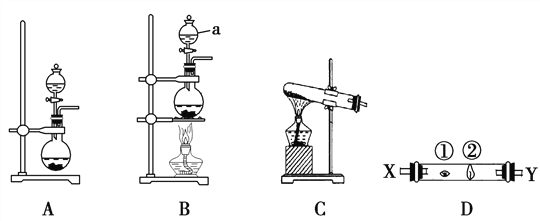
(3)写出装置B中仪器a的名称 ________________。
(4)实验室制取氯气还可采用如下原理:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,依据该反应原理选择_____________(填“A”或“B”或“C”)装置制取氯气。
(5)反应装置的导气管连接装置D的X导管,试回答下列问题:
①处发生反应的离子方程式为________________________________;
②处发生反应的离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某100 mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4 mol·L-1和0.4 mol·L-1。向该混合溶液中加入1.92 g铜粉,加热,待充分反应后(假设反应前 后溶液体积不变),所得溶液中Cu2+的物质的量浓度是( )
A. 0.15 mol·L-1 B. 0.225 mol·L-1
C. 0.30 mol·L-1 D. 0.45 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在密闭容器中反应A(g)+3B(g)2C(g) 在一定温度下达到平衡,
(1)在平衡时测得各物质的物质的量分别为n(A)=1.0mol、n(B)=0.4mol、n(C)=0.4mol,此时容器体积为2L,则此条件下的平衡常数K= .
(2)若保持温度和压强不变,在(1)中平衡中向上述容器中通入0.36mol A (g),平衡将(填“正向”、“逆向”或“不”)移动,用简要的计算过程说明理由 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A.NH4Cl溶液呈酸性,可用于去除铁锈
B.SO2具有还原性,可用于漂白纸张
C.Al2O3是两性氧化物,可用作耐高温材料
D.Na2SiO3溶液呈碱性,可用作木材防火剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com