
【题目】CH2= CHCH2OH可能发生的反应类型有:①加成反应②氧化反应③酯化反应④中和反应
A. 只有①③B. 只有①②③
C. 只有①③④D. 只有①②
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】在标准状况下有:①6.72LCH4,②3.01×1023个HCl分子,③13.6gH2S,④0.2molNH3。下列对这四种气体的描述正确的是( )
a. 体积②>③>①>④ b. 密度②>③>④>①
c. 质量②>③>①>④ d. 氢原子个数①>③>④>②
A. abc B. bcd C. abd D. abcd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P:akJmol-1、P-O:bkJmol-1、P=O:ckJmol-1、O=O:dkJmol-1.根据图示的分子结构和有关数据估算1mol白磷反应放出的热量,其中正确的是
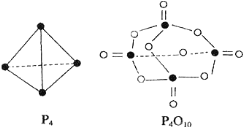
A. (6a+5d-4c-12b)kjB. (4c+12b-6a-5d)kJ
C. (4c+12b-4a-5d)kJD. (4a+5d-4c-12b)kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中作正极的是__________________ (填“A”或“B”) ;
(2)装置乙溶液中C电极反应:__________________________________;装置乙中反应一段时间后,测得C电极 的质量增加12.8克,则该电池反应转移电子的物质的量为___________mol
(3)装置丙中金属A上电极反应属于______________(填“氧化反应”或“还原反应”);
(4)四种金属活动性由强到弱的顺序是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的恒容密闭容器中充入6molCO2 和8molH2,发生反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H= -49.0kJmol-1,测得n(H2)随时间的变化如曲线Ⅰ所示。下列说法正确的是
CH3OH(g)+H2O(g) △H= -49.0kJmol-1,测得n(H2)随时间的变化如曲线Ⅰ所示。下列说法正确的是
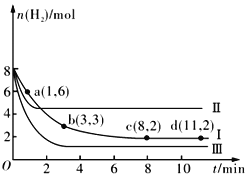
A. 该反应在0~8 min内CO2 的平均反应速率是0.375mol·L-1·min-1
B. 保持温度不变,若起始时向上述容器中充入4molCO2、2molH2、2molCH3OH(g)和1mol H2O(g),则此时反应向正反应方向进行
C. 保持温度不变,若起始时向上述容器中充入3molCO2 和4molH2,则平衡时H2 的体积分数等于20%
D. 改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸是一种有降压作用的药物,可由咖啡酸(一种芳香酸)与奎尼酸通过酯化反应合成。下列说法正确的是
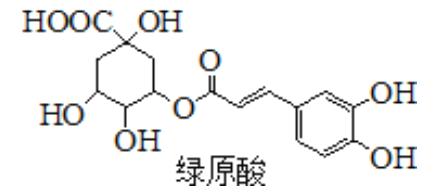
A. 绿原酸中有四个手性碳 B. 绿原酸所有原子可能共平面
C. 1mol奎尼酸与NaOH溶液反应,最多消耗5molNaOH D. 1mol奎尼酸最多与5mol溴水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】q电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×l0-7,K2=4.7×10-11 |
(1) 25℃时,等浓度的三种溶液(a.NaCN溶液、b.Na2CO3 溶液、c.CH3COONa 溶液)的pH由大到小的顺序为__________________。(填写序号)
(2)25℃时,向NaCN溶液中通入少量CO2, 所发生反应的化学方程式为__________________。
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+ )>c(CN-),下列关系正确的是__________________。
A. c(H+)>c(OH-) B.c(H+)-)
C. c(H+)+c(HCN)= C(OH-) D. c(HCN)+c(CN-)=0.01mol/L
(4)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
a | 0.1 | 0.1 | pH=9 |
b | c | 0.2 | pH=7 |
请回答:
①从a组情况分析,HA 是强酸还是弱酸___________________。
②b组情况表明,C____0.2 (选填“大于”“小于”或“等于”)。混合溶液中离子浓度c(A-)___c(Na+)(选填“大于”“小于”或“等于”)。
③a组实验所得混合溶液中由水电离出的c (OH-)=___mol/L。写出该混合溶液中下列算式的精确结果(不需做近似计算)。c (Na+)-c(A-)=____mol/L。
(5)已知在100℃时,水的离子积为1×10-12,此时将pH=11 的NaOH溶液V1 L与pH=2的H2SO4溶液V2L均匀混合后,若所得混合溶液的pH=10,则V1:V2为_________。
(6)HA为弱酸,在室温下,用蒸馏水稀释0.01 mol/L HA溶液时,下列呈减小趋势的是____。
A.c(H+)/c(A-) B.c(HA)/c(A-)
C.溶液中c(H+)和c(OH-)的乘积 D.溶液中c(A-)·c(HA)的值 E.水的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是

A. 离O点越远的元素原子半径越大 B. 虚线相连的元素处于同一族
C. B元素是图中金属性最强的元素 D. A、B组成的化合物中可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 油脂的水解反应称为皂化反应
B. 淀粉、蛋白质均含有C、H、O、N、P等元素
C. 酶是一种常见的催化剂,温度越高,催化活性越强
D. 向鸡蛋清溶液中加入饱和硫酸钠溶液会析出白色沉淀,加水沉淀会重新溶解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com