
【题目】q电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×l0-7,K2=4.7×10-11 |
(1) 25℃时,等浓度的三种溶液(a.NaCN溶液、b.Na2CO3 溶液、c.CH3COONa 溶液)的pH由大到小的顺序为__________________。(填写序号)
(2)25℃时,向NaCN溶液中通入少量CO2, 所发生反应的化学方程式为__________________。
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+ )>c(CN-),下列关系正确的是__________________。
A. c(H+)>c(OH-) B.c(H+)-)
C. c(H+)+c(HCN)= C(OH-) D. c(HCN)+c(CN-)=0.01mol/L
(4)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
a | 0.1 | 0.1 | pH=9 |
b | c | 0.2 | pH=7 |
请回答:
①从a组情况分析,HA 是强酸还是弱酸___________________。
②b组情况表明,C____0.2 (选填“大于”“小于”或“等于”)。混合溶液中离子浓度c(A-)___c(Na+)(选填“大于”“小于”或“等于”)。
③a组实验所得混合溶液中由水电离出的c (OH-)=___mol/L。写出该混合溶液中下列算式的精确结果(不需做近似计算)。c (Na+)-c(A-)=____mol/L。
(5)已知在100℃时,水的离子积为1×10-12,此时将pH=11 的NaOH溶液V1 L与pH=2的H2SO4溶液V2L均匀混合后,若所得混合溶液的pH=10,则V1:V2为_________。
(6)HA为弱酸,在室温下,用蒸馏水稀释0.01 mol/L HA溶液时,下列呈减小趋势的是____。
A.c(H+)/c(A-) B.c(HA)/c(A-)
C.溶液中c(H+)和c(OH-)的乘积 D.溶液中c(A-)·c(HA)的值 E.水的电离程度
【答案】 b>a>c NaCN+CO2+H2O=NaHCO3+HCN B、D HA是弱酸 大于 等于 10-5 (10-5-10-9)mol/L 2:9 BD
【解析】(1)电离平衡常数,CH3COOH>H2CO3>HCN,等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液水解程度为:Na2CO3溶液>NaCN溶液>CH3COONa溶液,故溶液的pH为:Na2CO3>NaCN>CH3COONa,故答案为:b>a>c;(2)NaCN和少量CO2反应生成NaHCO3、HCN,反应方程式为:NaCN+CO2+H2O=NaHCO3+HCN;(3)将0.02mol/L的HCN与0.01mol/L 的NaOH溶液等体积混合,溶液中的溶质是物质的量浓度都为0.005molL-1的NaCN、HCN,测得c(Na+)>c(CN-),根据电荷守恒可知:c(H+)<c(OH-),溶液呈碱性,所以HCN的浓度为0.005molL-1,CN-的浓度小于0.005molL-1,A.根据分析可知,溶液呈碱性,c(H+)<c(OH-),选项A错误;B.混合液呈碱性,则c(H+)<c(OH-),选项B正确;C.氢氧根离子浓度较小,c(CN-)远远大于c(OH-),选项C错误;D.根据物料守恒可知:c(HCN)+c(CN-)=0.01mol/L,选项D正确;答案选BD;(4)①从a组情况分析,等体积等浓度混合,恰好生成正盐,pH=9,则生成强碱弱酸盐,所以HA为弱酸;②若酸为强酸,等体积等浓度混合时pH=7;而HA为弱酸,等体积等浓度混合溶液的pH大于7,则为保证pH=7,应使酸浓度大于0.2mol/L;由电荷守恒可知c(Na+)+c(H+)=c(A-)+c(OH-),c(H+)=c(OH-),则c(A-)=c(Na+);③a组实验所得混合溶液为NaA溶液,溶液pH=9,说明NaA为强碱弱酸盐,溶液中的氢氧根离子是水电离的,即水电离的溶液中的c(OH-)=10-5mol/L;由电荷守恒可知c(Na+)+c(H+)=c(A-)+c(OH-),c(Na+)-c(A-)= c(OH-)- c(H+)=10-5mol/L -10-9mol/L = (10-5-10-9)mol/L;(5)在100℃时,水的离子积为1×10-12,此温度下将pH=11的NaOH溶液中c(OH-)=0.1mol/L,pH=2的H2SO4溶液c(H+)=0.01mol/L,若所得混合溶液的pH=10,则反应后的溶液的c(OH-)=![]() =0.01(mol/L),则c(OH-)=
=0.01(mol/L),则c(OH-)=![]() =0.01mol/L,解得:V1:V2=2:9;(6)A.加水稀释,c(A-)、c(H+)都减小,由于水也电离出氢离子,所以c(H+)减小的程度小,则
=0.01mol/L,解得:V1:V2=2:9;(6)A.加水稀释,c(A-)、c(H+)都减小,由于水也电离出氢离子,所以c(H+)减小的程度小,则![]() 会增大,选项A错误;B.加水稀释,促进电离,则n(A-)增大,n(HA)减小,所以
会增大,选项A错误;B.加水稀释,促进电离,则n(A-)增大,n(HA)减小,所以![]() 减小,选项B正确;C.溶液中c(H+)和c(OH-)的乘积为常数,温度不变,则 c(H+)和c(OH-)的乘积不变,选项C错误;D.加水稀释,溶液的体积增大,c(A-)与c(HA)均减小,所以溶液中c(A-)c(HA)的值减小,选项D正确;E.加水稀释,溶液的体积增大,c(H+)减小,对水的电离的抑制程度减小,所以水的电离程度增大,选项E错误;故答案为:BD。
减小,选项B正确;C.溶液中c(H+)和c(OH-)的乘积为常数,温度不变,则 c(H+)和c(OH-)的乘积不变,选项C错误;D.加水稀释,溶液的体积增大,c(A-)与c(HA)均减小,所以溶液中c(A-)c(HA)的值减小,选项D正确;E.加水稀释,溶液的体积增大,c(H+)减小,对水的电离的抑制程度减小,所以水的电离程度增大,选项E错误;故答案为:BD。


科目:高中化学 来源: 题型:
【题目】2011年3月11日在日本发生的大地震中,福岛核电站发生了核泄漏,其周边区域的空气中漂浮着放射性物质,其中含有碘的同位素13153I,13153I中的质子数为
A. 53 B. 78 C. 131 D. 184
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机玻璃是一种重要的塑料,有机玻璃的单体A(C6H10O2)不溶于水,并可以发生以下变化:
请回答下列问题:
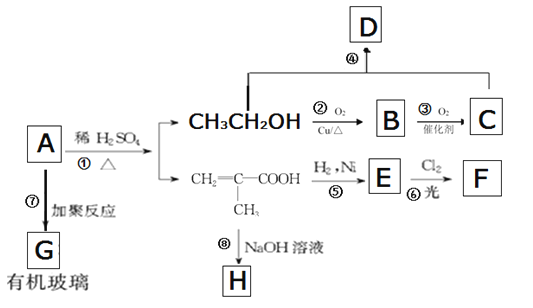
(1)有机玻璃的A结构简式是______________________________。
(2)有机物 中含有的官能团是______________、________________。
中含有的官能团是______________、________________。
(3)反应①的反应类型属于___________;反应⑤的反应类型属于________(选填序号)。
①氧化反应 ②还原反应 ③加成反应 ④取代反应
(4) E的结构简式为__________________________ ;G的结构简式为________________
(5) 反应②化学方程式是______________________________________
(6)反应④化学方程式是___________________________________________________
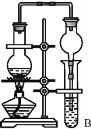
(7)某同学欲用如图装置制备物质D,试管B中装有足量的试剂是 ________________;插入试管B的导管接有一个球状物,其作用为___________________;如需将试管B中的物质D分离出来,用到的主要玻璃仪器有:烧杯、__________________。
(8)写出乙醇的同分异构体结构简式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH2= CHCH2OH可能发生的反应类型有:①加成反应②氧化反应③酯化反应④中和反应
A. 只有①③B. 只有①②③
C. 只有①③④D. 只有①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
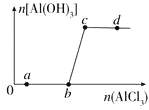
A. a点对应的溶液中:Na+、Fe3+、SO42-、HCO3-
B. b点对应的溶液中:Ag+、Ca2+、NO3-、F-
C. c点对应的溶液中:Na+、S2-、SO42-、Cl-
D. d点对应的溶液中:K+、NH4+、I-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式为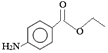 。下列关于苯佐卡因的叙述正确的是
。下列关于苯佐卡因的叙述正确的是
A. 分子中含有3种官能团
B. 1 mol该化合物最多与4 mol氢气发生加成反应
C. 苯环上有2个取代基,且含有硝基的同分异构体有15种
D. 1mol该有机物水解时只能消耗2molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是铝热反应的装置图,对该反应叙述正确的是( )
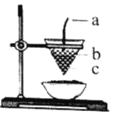
A. 图中a为镁条,b为KClO3,c为Al2O3和Fe的混合物
B. 铝热反应是放热反应,所以常温下可以发生反应
C. KClO3是该反应的催化剂
D. 利用铝热反应可焊接钢轨,也可冶炼锰等难熔金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是( )
A. c=1000b/11.2V B. p=m+Vc/125
C. n=m+17Vc D. 5m/3<p<17m/9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的一种重要手段,现有如图所示A~E五种仪器,请根据要求填空。
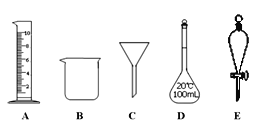
(1)写出仪器名称:C__________,E_________。
(2)下列实验操作中用到仪器E的是___________(填字母)。
a.分离水和CCl4的混合物
b.分离水和酒精的混合物
c.分离水和泥沙的混合物
d.分离NaCl溶液中的NaCl和水
(3)仪器A~E中使用前必须检查是否漏水的是_________。
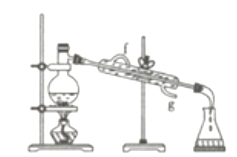
(4)若利用下图装置分离四氯化碳和酒精的混合物,则还缺少的仪器是____________,加热前应先在圆底烧瓶中加入几粒沸石,目的是_________________________;冷凝管的进水口是________(填“f”或“g”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com