
【题目】有机玻璃是一种重要的塑料,有机玻璃的单体A(C6H10O2)不溶于水,并可以发生以下变化:
请回答下列问题:
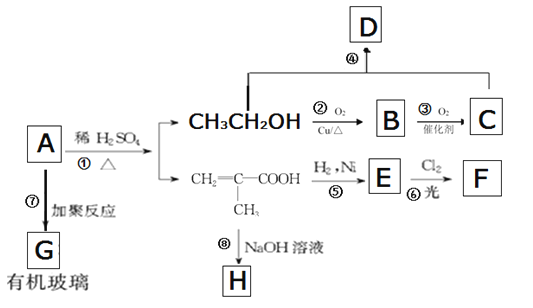
(1)有机玻璃的A结构简式是______________________________。
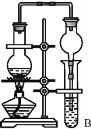
(2)有机物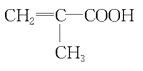 中含有的官能团是______________、________________。
中含有的官能团是______________、________________。
(3)反应①的反应类型属于___________;反应⑤的反应类型属于________(选填序号)。
①氧化反应 ②还原反应 ③加成反应 ④取代反应
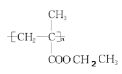
(4) E的结构简式为__________________________ ;G的结构简式为________________
(5) 反应②化学方程式是______________________________________
(6)反应④化学方程式是___________________________________________________
(7)某同学欲用如图装置制备物质D,试管B中装有足量的试剂是 ________________;插入试管B的导管接有一个球状物,其作用为___________________;如需将试管B中的物质D分离出来,用到的主要玻璃仪器有:烧杯、__________________。
(8)写出乙醇的同分异构体结构简式________________________。
【答案】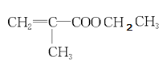
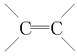 碳碳双键 —COOH(或 羧基) ④ ②③
碳碳双键 —COOH(或 羧基) ④ ②③ ![]()
 2CH3CH2OH+O2
2CH3CH2OH+O2![]() 2CH3CHO+2H2O CH3COOH+CH3CH2OH
2CH3CHO+2H2O CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 饱和碳酸钠溶液 防倒吸 分液漏斗 CH3OCH3
CH3COOCH2CH3+H2O 饱和碳酸钠溶液 防倒吸 分液漏斗 CH3OCH3
【解析】
根据框图中信息A能发生加聚反应生成有机玻璃,有机玻璃的结构简式为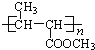 ,说明其中含有碳碳双键;同时A又能水解生成乙醇,说明A属于酯,乙醇在铜作催化剂的条件下氧化为乙醛,所以B为乙醛,乙醛可以继续氧化为乙酸,所以C为乙酸,乙醇和乙酸在催化剂条件下生成乙酸乙酯,所以D为乙酸乙酯,又知A水解过程中破坏的只是酯基,而碳碳双键保留了下来,CH2=C(CH3)COOH和NaOH溶液反应生成H,H为CH2=C(CH3)CONa,CH2=C(CH3)COOH和氢气加成反应生成E,E为CH3CH(CH3)COOH,E和氯气在光照条件下发生取代反应生成F,据此答题。
,说明其中含有碳碳双键;同时A又能水解生成乙醇,说明A属于酯,乙醇在铜作催化剂的条件下氧化为乙醛,所以B为乙醛,乙醛可以继续氧化为乙酸,所以C为乙酸,乙醇和乙酸在催化剂条件下生成乙酸乙酯,所以D为乙酸乙酯,又知A水解过程中破坏的只是酯基,而碳碳双键保留了下来,CH2=C(CH3)COOH和NaOH溶液反应生成H,H为CH2=C(CH3)CONa,CH2=C(CH3)COOH和氢气加成反应生成E,E为CH3CH(CH3)COOH,E和氯气在光照条件下发生取代反应生成F,据此答题。
(1)有机玻璃的A结构简式是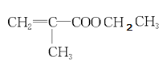 ,
,
故答案为: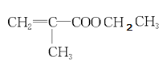 。
。
(2)有机物 中含有的官能团是碳碳双键(
中含有的官能团是碳碳双键( )、羧基(—COOH),
)、羧基(—COOH),
故答案为:碳碳双键( )、羧基(—COOH)。
)、羧基(—COOH)。
(3)反应①的反应类型属于取代反应,反应⑤CH2=C(CH3)COOH与氢气发生加成反应生成CH3CH(CH3)COOH,该反应也属于还原反应,
故答案为:④,②③。
(4)由分析可知,E的结构简式为![]() ,G的结构简式为
,G的结构简式为 ,
,
故答案为:![]() ,
, 。
。
(5)反应②是乙醇氧化为乙醛,化学方程式是2CH3CH2OH+O2![]() 2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2
2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。
(6)反应④是乙醇和乙酸在浓硫酸催化作用下生成乙酸乙酯,化学方程式为:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O。
CH3COOCH2CH3+H2O。
(7)欲用如图装置制备物质乙酸乙酯,试管B中装有足量的试剂是饱和碳酸钠溶液,饱和碳酸钠溶液的作用是:降低乙酸乙酯的溶解度,除去挥发出来的乙醇、乙酸;乙醇、乙酸在饱和的碳酸钠中溶解度比较大,而乙酸乙酯在饱和碳酸钠中的溶解度小,互不相溶,通过分液就可以得到乙酸乙酯,分液操作需要用到的玻璃仪器为分液漏斗、烧杯,插入试管B的导管接有一个球状物,其作用为防倒吸,故答案为:饱和碳酸钠溶液,防倒吸,分液漏斗。
(8)乙醇的分子式为C2H6O,乙醇和二甲醚互为同分异构体,二甲醚的结构简式CH3OCH3,故答案为:CH3OCH3。


科目:高中化学 来源: 题型:
【题目】25℃时,用Na2SO4溶液沉淀Ba2+、Pb2+、Ca2+三种金属离子(M2+),所需SO42-最低浓度的对数值p(SO42-)=-lgc(SO42-)与p(M2+)=-lgc(M2+)关系如图所示。下列说法正确的是

A. KSP(CaSO4)<KSP(PbSO4)<KSP(BaSO4)
B. a点可表示CaSO4的饱和溶液,且c(Ca2+)=c(SO42-)
C. b点可表示PbSO4的不饱和溶液,且c(Pb2+)<c(SO42-)
D. 向Ba2+浓度为10-5mol·L-1的废水中加入CaSO4粉末,会有BaSO4沉淀析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P:akJmol-1、P-O:bkJmol-1、P=O:ckJmol-1、O=O:dkJmol-1.根据图示的分子结构和有关数据估算1mol白磷反应放出的热量,其中正确的是
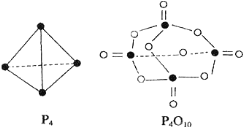
A. (6a+5d-4c-12b)kjB. (4c+12b-6a-5d)kJ
C. (4c+12b-4a-5d)kJD. (4a+5d-4c-12b)kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4) 是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:

(1)反应①应在温度较低的情况下进行(因在温度较高时KOH 与Cl2 反应生成的是KClO3。)写出①的化学方程式_____________________。
(2)在溶液I中加入KOH 固体的目的是_____________________。(填编号)
A.与反应液I中过量的Cl2继续反应,生成更多的KClO
B.KOH 固体溶解时会放出较多的热量,有利于反应进行
C.为下一步反应提供碱性的环境
D.使KClO3 转化为KClO
(3)从溶液Ⅱ中分离出K2FeO4 后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为__________________________________________。
(4)如何判断K2FeO4 晶体已经洗涤干净___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中作正极的是__________________ (填“A”或“B”) ;
(2)装置乙溶液中C电极反应:__________________________________;装置乙中反应一段时间后,测得C电极 的质量增加12.8克,则该电池反应转移电子的物质的量为___________mol
(3)装置丙中金属A上电极反应属于______________(填“氧化反应”或“还原反应”);
(4)四种金属活动性由强到弱的顺序是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的恒容密闭容器中充入6molCO2 和8molH2,发生反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H= -49.0kJmol-1,测得n(H2)随时间的变化如曲线Ⅰ所示。下列说法正确的是
CH3OH(g)+H2O(g) △H= -49.0kJmol-1,测得n(H2)随时间的变化如曲线Ⅰ所示。下列说法正确的是
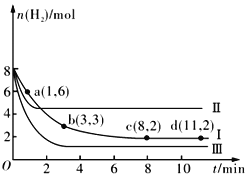
A. 该反应在0~8 min内CO2 的平均反应速率是0.375mol·L-1·min-1
B. 保持温度不变,若起始时向上述容器中充入4molCO2、2molH2、2molCH3OH(g)和1mol H2O(g),则此时反应向正反应方向进行
C. 保持温度不变,若起始时向上述容器中充入3molCO2 和4molH2,则平衡时H2 的体积分数等于20%
D. 改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】q电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×l0-7,K2=4.7×10-11 |
(1) 25℃时,等浓度的三种溶液(a.NaCN溶液、b.Na2CO3 溶液、c.CH3COONa 溶液)的pH由大到小的顺序为__________________。(填写序号)
(2)25℃时,向NaCN溶液中通入少量CO2, 所发生反应的化学方程式为__________________。
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+ )>c(CN-),下列关系正确的是__________________。
A. c(H+)>c(OH-) B.c(H+)-)
C. c(H+)+c(HCN)= C(OH-) D. c(HCN)+c(CN-)=0.01mol/L
(4)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
a | 0.1 | 0.1 | pH=9 |
b | c | 0.2 | pH=7 |
请回答:
①从a组情况分析,HA 是强酸还是弱酸___________________。
②b组情况表明,C____0.2 (选填“大于”“小于”或“等于”)。混合溶液中离子浓度c(A-)___c(Na+)(选填“大于”“小于”或“等于”)。
③a组实验所得混合溶液中由水电离出的c (OH-)=___mol/L。写出该混合溶液中下列算式的精确结果(不需做近似计算)。c (Na+)-c(A-)=____mol/L。
(5)已知在100℃时,水的离子积为1×10-12,此时将pH=11 的NaOH溶液V1 L与pH=2的H2SO4溶液V2L均匀混合后,若所得混合溶液的pH=10,则V1:V2为_________。
(6)HA为弱酸,在室温下,用蒸馏水稀释0.01 mol/L HA溶液时,下列呈减小趋势的是____。
A.c(H+)/c(A-) B.c(HA)/c(A-)
C.溶液中c(H+)和c(OH-)的乘积 D.溶液中c(A-)·c(HA)的值 E.水的电离程度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com