
【题目】常温下,Na2CO3和NaHCO3的混合溶液中c(![]() )、c(
)、c(![]() )与pH的关系如图所示[假设c(Na2CO3)+c(NaHCO3)=0.100 mol·L-1]。下列说法正确的是( )
)与pH的关系如图所示[假设c(Na2CO3)+c(NaHCO3)=0.100 mol·L-1]。下列说法正确的是( )
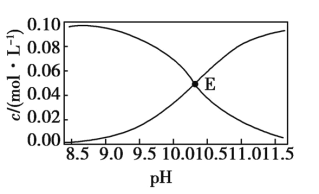
A.图中E点溶液表示浓度均为0.05 mol·L-1的Na2CO3和NaHCO3溶液混合后所得到的溶液
B.pH=10的溶液中:c(H+)+c(Na+)+c(H2CO3)=c(OH-)+c(![]() )
)
C.pH=11的溶液中:c(![]() )<c(
)<c(![]() )
)
D.向E点溶液中加入等体积0.100 mol·L-1的NaOH溶液,c(![]() )与c(
)与c(![]() )之和保持不变
)之和保持不变
【答案】C
【解析】
A. E点表示c(CO32-) = c(HCO3-),碳酸根的水解程度大于碳酸氢根,0.05 mol·L-1的Na2CO3和NaHCO3溶液混合后所得到的溶液不能使c(CO32-) = c(HCO3-),故A错误;
B. 根据物料守恒c(HCO3-)+c(CO32-)+c(H2CO3)=0.100mol/L和电荷守恒c(H+)+c(Na+)=c(OH-)+2c(CO32-)+ c(HCO3-)可知pH=10的溶液中:c(H+)+c(Na+)+c(H2CO3)=c(OH-)+c(CO32-)+0.100mol·L-1,故B错误;
C. 碳酸根的水解程度大于碳酸氢根,因此碳酸根的浓度越大,pH越大。二者浓度相等时,溶液的pH>10,因此pH=11的溶液中: c(Na2CO3) > c(NaHCO3), 故C正确;
D. 在E点溶液中加入等体积0.100mol·L-1的NaOH溶液碳酸氢钠转化为碳酸钠,根据物料守恒可知c(CO32-)与c(HCO3-)之和发生变化,故D错误;
正确答案是C。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论正确的是( )
图 1 图 2
图 2  图 3
图 3  图 4
图 4
A.由图1可知反应②的第I步比第Ⅱ步反应速率快
B.若图2为1 mL pH=2某一元酸溶液加水稀释时pH随溶液总体积的变化曲线,则说明该酸是强酸
C.由图3知反应3A(g)+2B(g) 2C(g) 的 ΔH>0,且a=1.5
D.若图4表示常温下用0.1000mo1/L NaOH溶液滴定25.00mL CH3COOH溶液的滴定曲线,则c(CH3COOH)=0.1000mo1/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应类型中,不正确的是
A.![]() +HNO3
+HNO3![]() +H2O取代反应
+H2O取代反应
B.CH3CH3+Cl2![]() CH3CH2Cl+HCl置换反应
CH3CH2Cl+HCl置换反应
C.CH2=CH2+H2O![]() CH3CH2OH加成反应
CH3CH2OH加成反应
D.2CH3CHO+O2![]() 2CH3COOH氧化反应
2CH3COOH氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应C(s)+H2O(g) ![]() CO(g)+H2(g) ΔH在一定温度和压强下于密闭容器中达到平衡。下列叙述正确的是( )
CO(g)+H2(g) ΔH在一定温度和压强下于密闭容器中达到平衡。下列叙述正确的是( )
A.升高温度,平衡常数K增大,则ΔH<0
B.缩小容器体积,c(CO)减小
C.恒压条件下,充入一定量的氮气,n(H2)增大
D.更换高效催化剂,H2O(g)的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g) ![]() 2C(g)+D(s),所得实验数据如下表:
2C(g)+D(s),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(A) | n(B) | n(C) | ||
① | 600 | 0.30 | 0.20 | 0.30 |
② | 700 | 0.20 | 0.30 | 0.24 |
③ | 800 | 0.10 | 0.10 | a |
下列说法不正确的是
A. 实验①中,若5min时测得n(B)=0.050mol,则0至5min时间内平均反应速率v(A)=0.015mol/(L·min)
B. 实验②中达到平衡后,增大压强,A的转化率不变,平衡常数不变
C. 700℃时该反应的平衡常数K=4.0
D. 实验③中,达到平衡时,a>0.10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳族、氮族元素及其化合物在生产、生活和环境保护中应用广泛。
(1)下列有关物质性质递变的描述中,正确的是________________(填代号)。
A.酸性:HNO3>H2CO3>H2SiO3 B.稳定性:NH3>AsH3>PH3
C.稳定性:N2<P4(白磷) D.常温下,同浓度溶液的pH:Na3PO4<Na3AsO4
(2)已知:
(a)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3 kJ·mol1
(b)2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol1
(c)C(s)+O2(g)=CO2(g) ΔH3=-393.5 kJ·mol1
①C(s)+2H2(g)=CH4(g) ΔH=___________kJ·mol1。
②CH4制备合成气的原理是CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
A. 下列叙述不能表示该反应在恒温恒容条件下达到平衡状态的是____。
a. 混合气体的压强不再发生变化
b. 混合气体的密度不再发生变化
c. 反应容器中CO2、CO的物质的量的比值不再发生变化
d. 混合气体的平均相对分子质量不再发生变化
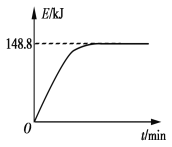
B. 若1 g CH4(g)完全反应吸收热量为15.5 kJ。在恒容密闭容器中充入1 mol CH4和1 mol CO2在一定条件下反应,体系吸收热量随着时间变化如图所示。在该条件下,甲烷的最大转化率(α)为____________。
(3)在密闭容器中发生反应:2NO(g)+H2(g)= N2(g)+2H2O(g),其反应速率与浓度关系式为v=kcm(NO)·cn(H2)(k为常数,只与温度有关,m、n为反应级数,取正整数),在某温度下测得有关数据如表所示。
序数 | c(NO)/(mol·L1) | c(H2)/(mol·L1) | v/(mol·L1·min1) |
Ⅰ | 0.10 | 0.10 | 0.414 |
Ⅱ | 0.20 | 0.20 | 3.312 |
Ⅲ | 0.10 | 0.20 | 0.828 |
总反应分两步进行:第i步,2NO+H2=N2+H2O2(很慢);第ii步,H2O2+H2![]() 2H2O(很快)。在上述温度下,当c(NO)=c(H2)=0.50 mol·L1时v=_________mol·L1·min1。
2H2O(很快)。在上述温度下,当c(NO)=c(H2)=0.50 mol·L1时v=_________mol·L1·min1。
(4)在2 L恒容密闭容器中充入3 mol NO(g)和3 mol CO(g),发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),在一定温度下达到平衡,测得平衡体系中c(N2)=0.5 mol·L1。则该条件下平衡常数K值为_______。反应前后容器内气体压强之比为_________________________。
N2(g)+2CO2(g),在一定温度下达到平衡,测得平衡体系中c(N2)=0.5 mol·L1。则该条件下平衡常数K值为_______。反应前后容器内气体压强之比为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A. 该溶液的pH=4 B. 升高温度,溶液的pH和电离平衡常数均减小
C. 此酸的电离平衡常数约为1×10-7 D. 加入少量纯HA,电离程度减小电离平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是:
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH为2的氢氟酸稀释100倍后,pH<4。则250C时,将0.1mol·L-1的HF加水不断稀释,下列表示的量保持不变的是( )
①n(H+); ②c(H+)·c(OH—);③c(OH—)+ c(F—);④![]() ⑤
⑤![]() ;
;
A.①③④B.②③④C.③④⑤D.②⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com