


| ||
| ||
| ||
| ||
| 12g |
| 16g |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、常温下,反应4Na(s)+O2(g)═2Na2O(s)的△H<0,△S>0 | |||
| B、反应2A(g)+B(g)═3C(s)+D(g)在一定条件下能自发进行,说明该反应的△H<0 | |||
| C、合成氨生产中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 | |||
D、反应2SO2+O2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A、X元素在周期表中的位置是第三周期第Ⅱ族 |
| B、X和W能形成离子化合物 |
| C、Y的最高价氧化物对应的水化物能溶于稀氨水 |
| D、Z的氢化物的稳定性比W的氢化物的稳定性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
| B、CH2=CH2+Cl2+Ca(OH)2→CH2-CH2+CaCl2+H2O |
C、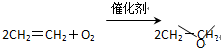 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用高锰酸钾溶液滴定Na2SO3溶液至终点:滴入最后一滴高锰酸钾溶液,溶液恰好由紫色变为无色,且半分钟不变色 |
| B、通常用产生气泡的快慢,比较不同条件下Na2S2O3溶液与稀硫酸反应速率 |
| C、润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从下口放出,重复2~3次 |
| D、制备硫酸亚铁晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液被全部蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 50mL 0.50mol?L-1的盐酸与50mL 0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热,完成下列问题:
50mL 0.50mol?L-1的盐酸与50mL 0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热,完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com