
(17分)铁、铜及其化合物在工农业生产中应用广泛。
(1)在潮湿空气中,钢铁发生电化学腐蚀转化为Fe(OH)2的反应方程式为 。在含有等浓度硫酸溶液的下列装置中,铁腐蚀的速率由快到慢的顺序是 (用序号填写)。

(2)已知:①3Fe(s)+2O2(g)=Fe3O4(s)  H=-1118 kJ·mol-1
H=-1118 kJ·mol-1
②2Al(s)+3/2O2(g)=A12O3(s)  H=-1675.7 kJ·mol-1
H=-1675.7 kJ·mol-1
则焊接钢轨时铝与Fe3O4发生反应生成铁和Al2O3的热化学方程式为 。
(3)Na2FeO4具有强氧化性,其电解制法如图所示,请写出阳极的电极反应式 。Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其原理是 。

(4)工业上常用FeCl3溶液腐蚀印刷线路板,发生反应的离子方程式是 。若腐蚀铜板后的溶液中,Cu2+、Fe3+和Fe2+浓度均为0.1 mol·L-1 ,结合下图分析,当混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为 。从图中数据计算Fe(OH)2的溶度积Ksp[Fe(OH)2]= 。

已知:横坐标为溶液的pH,纵坐标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度 10-5 mol·L-1时,可认为沉淀完全)。
10-5 mol·L-1时,可认为沉淀完全)。
(17分)(1)2Fe + O2 + 2H2O = 2Fe(OH)2 (2分) ⑤③②①④(2分)
(2)8Al(s)+3Fe3O4(s)=4Al2O3(s)+9Fe(s) △H= 3349.8 kJ·mol-1(2分)
(3)Fe + 8OH- -6e-= FeO42- + 4H2O (2分)
Na2FeO4具有强氧化性,能起到杀菌、消毒作用;高价的铁被还原成的Fe3+水解生成Fe(OH)3胶体,能吸附水中杂质。(3分,仅答对1点给2分)
(4)2Fe3+ + Cu = 2Fe2+ +Cu2+ (2分) ;Cu2+、Fe2+(2分); 1.0×10-17(mol·L-1)3(2分)
【解析】
试题分析:(1)在潮湿空气中,钢铁发生电化学腐蚀转化为Fe(OH)2的反应方程式为: 2Fe + O2 + 2H2O = 2Fe(OH)2;①Zn为负极,Fe为正极,Fe受到保护;②Fe与硫酸发生置换反应,被氧化变为Fe2+,比①腐蚀的快;③构成Fe-Cu原电池,Fe作负极,首先被腐蚀,腐蚀速率③>②;④形成电解池,Fe为阴极,被保护,只要存在外加电源,Fe就不会被腐蚀,所以腐蚀速率④<①;⑤构成电解池。由于Fe为阳极,被氧化,发生氧化反应,腐蚀速率比③快。所以铁腐蚀的速率由快到慢的顺序是⑤③②①④;
(2)②×4-①×3,整理可得:8Al(s)+3Fe3O4(s)=4Al2O3(s)+9Fe(s) △H= 3349.8 kJ·mol-1;(3)Na2FeO4具有强氧化性,其电解制法如图所示,则在阳极,Fe失去电子,被氧化,与溶液中的OH-结合反应,阳极的电极反应式是Fe + 8OH- -6e-= FeO42- + 4H2O;Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其原理是Na2FeO4中的Fe化合价为+6价,具有强氧化性,能起到杀菌、消毒作用;高价的铁被还原成的Fe3+发生水解反应生成Fe(OH)3胶体,表面积大,吸附能力强,能吸附水中杂质,使之形成沉淀,从水中分离出去,从而使水得到净化。(4)工业上常用FeCl3溶液腐蚀印刷线路板,Fe3+将Cu单质氧化为Cu2+,Fe3+被还原变为Fe2+,根据电子守恒、电荷守恒及原子守恒,可得发生反应的离子方程式是2Fe3+ + Cu = 2Fe2+ +Cu2+;根据图像可知,在溶液的pH接近3而小于3时,Fe3+已经沉淀完全。所以在溶液的pH=5.6时,溶液中存在的金属阳离子为Cu2+、Fe2+;Fe(OH)2的溶度积Ksp[Fe(OH)2]=c(Fe2+)c2(OH-)=10-5×(10-14÷10-8)2 1.0×10-17(mol·L-1)3。
考点:考查化学反应方程式的书写、金属腐蚀快慢比较、电解原理在物质制备的作用、水的消毒净化的原因分析、氧化还原反应在工业上的应用、沉淀溶解平衡原理的应用的知识。
考点分析: 考点1:溶解平衡 考点2:离子浓度比较 考点3:电解池 考点4:金属的电化学腐蚀与防护 试题属性

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年福建省泉州市高三3月月考理综化学试卷(解析版) 题型:选择题
四种短周期元素在周期表中的位置如图,其中X元素的原子最外层电子数等于其电子层数。下列说法不正确的是
Z | W | ||
X | Y |
A.X位于元索周期表中第3 周期、ⅢA族
B.原子半径:X > Z > W
C.最简单气态氢化物的热稳定性:W > Y
D.Y的最高价氧化物可以和W的最简单氢化物反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省商丘市高三第一次模拟考试化学试卷(解析版) 题型:选择题
某溶液中含有 、Mg2+、Fe2+、Al3+、
、Mg2+、Fe2+、Al3+、 、
、 六种离子,若向其中加入过量的氢氧化钡溶液,微热并搅拌,再加入过量的氢碘酸,充分反应后溶液中大量减少的离子有
六种离子,若向其中加入过量的氢氧化钡溶液,微热并搅拌,再加入过量的氢碘酸,充分反应后溶液中大量减少的离子有
A. 、Fe2+、
、Fe2+、 B.
B. 、
、 、
、
C.Mg2+、Fe2+、 D.Fe2+、Al3+、
D.Fe2+、Al3+、
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三年级3月适应性训练理综化学试卷(解析版) 题型:填空题
(14分)物质的类别和核心元素的化合价是研究物质性质的两个基本视角。

(1)图中X的电子式为 ;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O (填“强”或“弱”)。用原子结构解释原因:同主族元素最外层电子数相同,从上到下, ,得电子能力逐渐减弱。
(2)Na2S2O3是一种用途广泛的钠盐。
①下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是______(填字母序号)。
a. Na2S + S b. Z + S c. Na2SO3 + Y d. NaHS + NaHSO3
②已知反应:Na2S2O3 + H2SO4 == Na2SO4 + S↓+SO2↑+H2O。研究其反应速率时,下列说法正确的是 (填写字母序号)。
a.可通过测定一段时间内生成SO2的体积,得出该反应的速率
b.可通过比较出现浑浊的时间,研究浓度、温度等因素对该反应速率的影响
c.可通过Na2S2O3固体与稀硫酸和浓硫酸的反应,研究浓度对该反应速率的影响
(3)治理含CO、SO2的烟道气,可以将其在催化剂作用下转化为单质S和无毒的气体。
已知:①CO(g)+ 1/2 O2(g)=CO2(g) △H=-283 kJ·mol-1
②S(s)+ O2(g)=SO2(g) △H=-296 kJ·mol-1
①则治理烟道气反应的热化学方程式为 。
②一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是 (填写字母序号)。
a.v (CO) ∶v(SO2) = 2∶1
b.平衡常数不变
c.气体密度不变
d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为 ,则SO2的转化率为 。
,则SO2的转化率为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三年级3月适应性训练理综化学试卷(解析版) 题型:选择题
依据下图判断,下列说法正确的是

A.2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g) 所具有的总能量低
B.氢气的燃烧热为△H = -241.8 kJ·mol-1
C.液态水分解的热化学方程式为:2H2O(l) == 2H2(g) + O2(g) △H = +571.6 kJ·mol-1
D.H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省枣庄市高三下学期开学初检测试卷理综化学试卷(解析版) 题型:选择题
下列关于有机物 的叙述不正确的是
的叙述不正确的是
A.分子式为C6H10O
B.可发生加成、酯化和氧化反应
C.分子中有两种官能团
D.与HBr、溴水发生加成反应,产物都只有一种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省文登市高三第二次统考理科综合化学试卷(解析版) 题型:填空题
(16分)MnO2是重要化学物质,某学习小组设计了将粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品转化为纯MnO2实验,其流程如下:
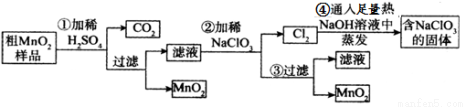
按要求回答下列问题
(1) 第②步操作中,氧化性强弱顺序:ClO3-______ MnO2 (填“>”“<”),当NaClO3转移2mol电子时,生成的氧化产物的物质的量为________mol。NaClO3在常温下能够与盐酸反应生成氯气,该反应的离子方程式为___________________。
(2)第④步操作中,最终得到的固体除NaClO3外,还一定含有下列物质中的_________
a.NaCl b.NaClO c.NaClO4 d.NaOH
(3)MnO2是碱性锌锰电池的正极材料,则碱性锌锰电池放电时,正极的电极反应式是:__________。
(4)为得到纯净的MnO2,须将过滤后的MnO2合并后进行洗涤,判断是否洗涤干净可选用的试剂是______(填写一组即可)。工业上可以以石墨为电极电解酸化的硫酸锰制取二氧化锰,该反应的阳极反应式为_____________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高三第一次模拟考试理科综合化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数,下列说法正确的是
A.0.l mol的 分子中的中子数是2
分子中的中子数是2
B.标准状况下,一定量的铜与硝酸反应后生成22.4 LNO、NO2、N2O4的混合气体,则被还原的硝酸的分子数大于
C.100mL 1 mol /LNa[Al(OH)4]溶液中含有0.1 个[Al(OH)4]-
个[Al(OH)4]-
D.1 mol羟基和1mol氢氧根离子中的电子数和质子数均相等
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省泰安市高三下学期一模理科综合化学试卷(解析版) 题型:填空题
【化学——化学与技术】火山喷发所产生的硫磺可用于生产重要的化工原料——硫酸。某企业用下图所示的工艺流程生产硫酸:

请回答下列问题:
(1)①为充分利用反应放出的热量,转化器中应安装______(填设备名称)。吸收塔中填充有许多瓷管,其作用是________;
②为使硫磺充分燃烧,经流量计l通入燃烧室的氧气过量50%。为提高SO2转化率,经流量计2的氧气量为转化器中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计l和流量计2的空气体积比应为______。b管排出的尾气的处理方法是________.
③与以硫铁矿为原料的生产工艺相比,该工艺的特点是_________(填字母序号)。
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废气减少 D.不需要使用催化剂
(2)硫酸的用途非常广泛;其中可应用于下列哪些方面__________(填字母序号)。
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产 D.过磷酸钙的制备
(3)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式___________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com