
用NA表示阿伏加德罗常数,下列说法正确的是
A.0.l mol的 分子中的中子数是2
分子中的中子数是2
B.标准状况下,一定量的铜与硝酸反应后生成22.4 LNO、NO2、N2O4的混合气体,则被还原的硝酸的分子数大于
C.100mL 1 mol /LNa[Al(OH)4]溶液中含有0.1 个[Al(OH)4]-
个[Al(OH)4]-
D.1 mol羟基和1mol氢氧根离子中的电子数和质子数均相等
B
【解析】
试题分析:A、0.lmol的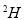 分子中的中子数是NA,错误;B、标准状况下,一定量的铜与硝酸反应后生成22.4LNO、NO2、N2O4的混合气体,由于反应中产生水,使硝酸由浓变稀,反应速率减慢,产生气体的量逐渐减小,那么被还原的硝酸的分子数大于NA,正确;C、100mL1mol/LNa[Al(OH)4]溶液中[Al(OH)4]-少于0.1NA个,错误;D、羟基和氢氧根离子的电子数和中子数不同,所以1mol羟基和1mol氢氧根离子中的电子数和质子数均不相等,错误;故本题选择C。
分子中的中子数是NA,错误;B、标准状况下,一定量的铜与硝酸反应后生成22.4LNO、NO2、N2O4的混合气体,由于反应中产生水,使硝酸由浓变稀,反应速率减慢,产生气体的量逐渐减小,那么被还原的硝酸的分子数大于NA,正确;C、100mL1mol/LNa[Al(OH)4]溶液中[Al(OH)4]-少于0.1NA个,错误;D、羟基和氢氧根离子的电子数和中子数不同,所以1mol羟基和1mol氢氧根离子中的电子数和质子数均不相等,错误;故本题选择C。
考点:阿伏伽德罗常数的基本计算
考点分析: 考点1:化学计算 考点2:化学用语及其规律 试题属性

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源:2014-2015学年北京市石景山区高三上学期期末考试化学试卷(解析版) 题型:选择题
下列物质性质与应用对应关系不正确的是
A.明矾在天然水中生成Al(OH)3胶体,可用作自来水的消毒剂
B.SO2有漂白性,工业上常用它来漂白纸浆
C.单质硅具有半导体性能,可以制成光电池
D.Fe2O3是一种红棕色粉末,常用作红色油漆
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省枣庄市高三下学期开学初检测试卷理综化学试卷(解析版) 题型:填空题
(17分)铁、铜及其化合物在工农业生产中应用广泛。
(1)在潮湿空气中,钢铁发生电化学腐蚀转化为Fe(OH)2的反应方程式为 。在含有等浓度硫酸溶液的下列装置中,铁腐蚀的速率由快到慢的顺序是 (用序号填写)。

(2)已知:①3Fe(s)+2O2(g)=Fe3O4(s)  H=-1118 kJ·mol-1
H=-1118 kJ·mol-1
②2Al(s)+3/2O2(g)=A12O3(s)  H=-1675.7 kJ·mol-1
H=-1675.7 kJ·mol-1
则焊接钢轨时铝与Fe3O4发生反应生成铁和Al2O3的热化学方程式为 。
(3)Na2FeO4具有强氧化性,其电解制法如图所示,请写出阳极的电极反应式 。Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其原理是 。

(4)工业上常用FeCl3溶液腐蚀印刷线路板,发生反应的离子方程式是 。若腐蚀铜板后的溶液中,Cu2+、Fe3+和Fe2+浓度均为0.1 mol·L-1 ,结合下图分析,当混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为 。从图中数据计算Fe(OH)2的溶度积Ksp[Fe(OH)2]= 。

已知:横坐标为溶液的pH,纵坐标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度 10-5 mol·L-1时,可认为沉淀完全)。
10-5 mol·L-1时,可认为沉淀完全)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省文登市高三第二次统考理科综合化学试卷(解析版) 题型:选择题
乌头酸的结构简式如图所示,下列关于乌头酸的说法正确的是

A.化学式为C8H6O6
B.乌头酸可发生加成反应和取代反应
C.乌头酸分子中能发生酯化反应的官能团有2种
D.1mol乌头酸与足量的钠反应生成3molH2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高三第一次模拟考试理科综合化学试卷(解析版) 题型:选择题
有关下列图像的说法正确的是

A.图①可以表示,某化学平衡体系改变温度后反应速率随时间的变化
B.根据图②判断,物质A反应生成物质C的△H>O
C.图③表示向一定量的硫酸溶液中滴加一定浓度氢氧化钠溶液时的pH变化
D.图④中开关K置丁A或B处均可减缓铁的腐蚀
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省宁波市高三上学期期末考试化学试卷(解析版) 题型:填空题
(12分)味精厂、化肥厂、垃圾渗滤液等排放的废水中往往含有高浓度的氨氮,若不经处理直接排放会对水体造成严重的污染。
(1)生物硝化法:在富氧条件下,通过硝酸盐菌的作用,将氨氮(以 NH4+表示,下同)氧化成硝酸盐,其反应的离子方程式为 。
(2)MAP 沉淀法:向氨氮废水中投加磷酸盐和镁盐,使之和 NH4+生成难溶复盐MgNH4PO4·6H2O(简称MAP)结晶,是一种比较新颖有效的处理方法。
①用离子方程式表示反应的原理 。
②MAP沉淀法需要控制反应的pH 在 7.5~10 之间。当 pH>10时,由于 而不利于MAP的生成。
(3)电化学氧化法:电化学去除氨氮主要是氯气和次氯酸的间接氧化作用。对某养猪场废水进行电化学氧化处理,选用 IrO2-TiO2/Ti电极作为阳极,阴极采用网状钛板,加入一定量的NaCl,调节溶液的pH,在电流密度为 85 mA·cm-2下电解,180 min内去除率达到98.22%。
①阳极发生的电极反应式是 ; HClO 氧化除去氨氮的反应离子方程式是 。
②为了提高氨氮的去除率,需要控制溶液中 Cl-的浓度和 pH,根据下图判断: Cl-的适宜浓度为 ,适宜的 pH 为 。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省宁波市高三上学期期末考试化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.Na2CO3溶液中加入少量BaCl2晶体,CO32-水解程度减小,溶液的 pH 也减小
B.SO2能与HClO 反应生成H2SO4,则可以说明HClO 酸性比H2SO4强
C.向装有 Fe(NO3)2溶液的试管中加入稀 H2SO4,在试管口观察到红棕色气体,是因为HNO3分解产生了NO2
D.反应NH3(g)+HCl(g)=NH4C1(s)在室温下可自发进行,则该反应的△H<0
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省烟台市高三下学期一模诊断测试理科综合化学试卷(解析版) 题型:实验题
(19分)过氧化钙是一种重要的化工原料,温度在350℃以上容易分解。
(1)利用反应Ca(s)+O2 CaO2(s),在纯氧条件下,制取CaO2的装置示意图如下:
CaO2(s),在纯氧条件下,制取CaO2的装置示意图如下:

请回答下列问题:
①装置A中反应的化学方程式为____________;仪器a的名称为__________;装置D中盛有的液体是浓硫酸,其作用一是观察氧气的流速,判断氧气通入是否过快及氧气与钙反应进行的程度;二是_______________。仪器安装后应进行的实验操作:
a.通入氧气
b.检查装置气密性
c.加入药品
d.停止通氧气
e.点燃酒精灯
f.熄灭酒精灯
g.冷却至室温,
正确的操作顺序为________。
②完全反应后,有关数据记录如下:
空瓷舟质量m0/g | 瓷舟与钙的质量m1/g | 瓷舟与产物的质量m2/g |
14.80 | 15.08 | 15.25 |
据此可判断m2与理论值不符,则产物中的杂质可能是_________________________。
(2)利用反应Ca2++H2O2+2NH3·H2O+6H2O=CaO2·8H2O+2NH4+,在碱性环境中,制取CaO2的流程示意图如下:

请回答下列问题:
①主反应中,NH3·H2O在Ca2+和H2O2的反应历程中所起的作用是_______________;该反应所需的条件及操作为_______(填字母)。
a.把氯化钙溶液逐滴加入过氧化氢—氨水溶液中
b.把过氧化氢—氨水溶液逐滴加入氯化钙溶液中
c.滴加时先搅拌后静置,观察晶体析出
d.滴加时不停搅拌,直至晶体完全析出
e.反应体系热水浴加热 f.反应体系冰水浴冷却
洗涤CaO2·8H2O晶体时,判断晶体是否完全洗净的试剂为_____;滤液循环使用时需在反应器中加入一种物质,该物质的化学式为_____。
②利用反应2CaO2 2CaO+O2↑测量产品中CaO2含量时,停止反应且冷却至25℃后的装置示意图如下:若直接读数确定25℃、1大气压下气体的体积,则测量结果______(填“偏大”、“偏小”或“无影响”)。
2CaO+O2↑测量产品中CaO2含量时,停止反应且冷却至25℃后的装置示意图如下:若直接读数确定25℃、1大气压下气体的体积,则测量结果______(填“偏大”、“偏小”或“无影响”)。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省中山市高三下学期第二次模拟考试理科综合化学试卷(解析版) 题型:选择题
用0.1mol·L—1的盐酸滴定0.1mol·L—1的氨水,在滴定过程中不可能出现的结果是
A.c(NH4+)>c(Cl-),c(OH-)>c(H+)
B.c(NH4+)=c(Cl-),c(OH-)=c(H+)
C.c(Cl-)>c(NH4+),c(OH-)>c(H+)
D.c(Cl-)>c(NH4+),c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com