
【题目】将如图所示实验装置的K闭合,下列判断不正确的是( )
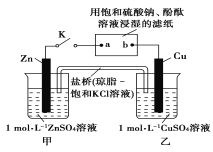
A.Cu电极上发生还原反应
B.片刻后甲池中c(SO42-)不变
C.电子沿Zn→a→b→Cu路径流动
D.片刻后可观察到滤纸a点变红
【答案】C
【解析】
甲、乙装置能自发的进行氧化还原反应,所以是原电池,锌易失电子作负极,铜作正极,则含有硫酸钠溶液的滤纸是电解池,a是阴极,b是阳极,阴极上氢离子放电,阳极上氢氧根离子放电,电子从负极沿导线流向电解池阴极,原电池放电时,阴离子向负极移动,阳离子向正极移动。
甲、乙装置能自发的进行氧化还原反应,所以是原电池,锌易失电子作负极,铜作正极,则含有硫酸钠溶液的滤纸是电解池,a是阴极,b是阳极。
A、铜电极上铜离子得电子发生还原反应而生成铜,选项A正确;
B、硫酸根离子浓度基本保持不变,选项B正确;
C、电子流向是负极到正极,但a→b这一环节是在溶液中导电,是离子导电,电子并没沿此路径流动,选项C不正确;
D、滤纸a点是阴极,氢离子放电,水电离平衡破坏,附近氢氧根离子浓度增大,酚酞变红,选项D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
H2O(g)═H2(g)+![]() O2(g)△H=+241.8kJ/mol
O2(g)△H=+241.8kJ/mol
H2(g)+![]() O2(g)═H2O(1)△H=﹣285.8kJ/mol
O2(g)═H2O(1)△H=﹣285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是
A.吸热44kJB.吸热2.44KJC.放热44kJD.放热2.44KJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐易溶于水,而其钙盐为沉淀。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。甲组、乙组两位同学对草酸分解产物进行探究。甲组同学认为:草酸分解产物中有CO2;乙组同学认为:草酸分解产物中还有CO。回答下列问题:
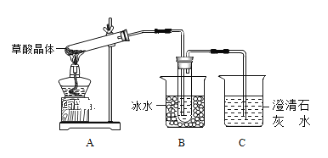
(1)甲组同学按照上图所示的装置连接,通过实验检验草酸晶体的分解产物。加热A装置前需要进行的操作是______________________;装置C中可观察到的现象是______________________________,装置C中发生的化学方程式_________________;由此可知草酸晶体分的产物中有___________(填化学式)。
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验.
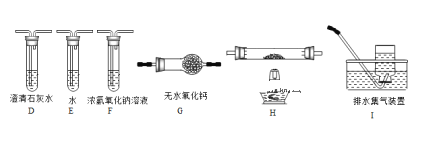
①乙组同学的实验装置中,依次连接的合理顺序为A、B、F、D、G____________(按合理顺序补全装置,填大写字母)。装置H反应管中盛有的物质是______________,此反应管中发生反应的化学方程式是_______________________。
②能证明草酸晶体分解产物中有CO的现象是_____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列几个装置示意图,有关叙述不正确的是( )
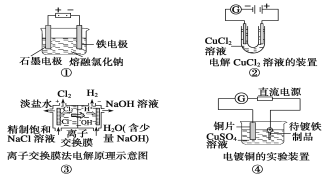
A.装置①工业上可用于生产金属钠,电解过程中石墨电极产生氯气,此法也可用于生产活泼金属镁、铝等
B.装置②中随着电解的进行右边电极会产生红色的铜,并且电流计示数不断变小
C.装置③中的离子交换膜具有很强的选择性,只允许某类离子(如Na+)通过
D.装置④的待镀铁制品应与电源负极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银白色固体A:①放在空气中可氧化生成白色固体B;②将A点燃,火焰呈黄色,生成淡黄色固体C;③A、B、C均可与无色液体D反应,生成碱性物质E,其中A跟D反应时还可以生成可燃性气体F,C跟D反应则生成另一种气体G;④F和G混合后遇火可剧烈反应而发生爆炸,并生成D。据此判断:
(1)A______,B______,C______,D________,E____,F_______,G_______。(填化学式)
(2)写出有关反应的化学方程式:
①___________________________________________。
②__________________________________________。
③__________________________________________。
④__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸盐(ClO4-)有高稳定性和强氧化性,常作为氧化剂用于工业生产。
(1)高氯酸盐中氯元素的化合价为________。
(2)下列叙述中可说明氯元素比硫元素非金属性强的是_________。
① HCl比H2S稳定
② HClO4的酸性比H2SO3的强
③ Cl2可与Na2S发生置换反应
(3)NH4ClO4是复合火箭推进剂的重要成分,实验室可通过反应NaClO4+NH4Cl![]() NH4ClO4+NaCl制取。相关物质的溶解度曲线如图:
NH4ClO4+NaCl制取。相关物质的溶解度曲线如图:
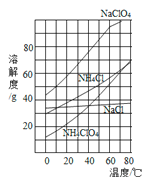
① 结合溶解度,分析该反应能够发生的原因________。
② 从反应后热的混合液中获得较多NH4ClO4晶体的实验操作依次为________、蒸发浓缩、冷却结晶、过滤、冰水洗涤。
(4)高氯酸盐是一种新型的无机污染物,ClO4-的主要危害是与碘离子竞争进入人体甲状腺,影响甲状腺的正常功能。利用电化学催化法,酸性环境中,可将ClO4-还原为Cl-,该电极反应式为________。
(5)已知,加热时Cu(ClO4)2的分解方式有以下两种:
2Cu(ClO4)2 ![]() 2CuO+7O2↑+2Cl2↑
2CuO+7O2↑+2Cl2↑
Cu(ClO4)2 ![]() CuCl2+4O2↑
CuCl2+4O2↑
取一定质量的Cu(ClO4)2·6H2O样品,加热至某温度使其完全分解,若测得V(O2)∶V(Cl2)=5∶1,则分解所得固体产物中CuO与CuCl2的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒。这是因为对人体无害的![]() 价砷类化合物在维生素C的作用下,能够转化为有毒的
价砷类化合物在维生素C的作用下,能够转化为有毒的![]() 价的含砷化合物。通过以上信息填空:
价的含砷化合物。通过以上信息填空:
①维生素C具有______(填“氧化性”或“还原性”)。
②3mol +5价砷完全转化为![]() 价砷,共转移______个电子。
价砷,共转移______个电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧印刷电路板中铜元素含量较高,为充分利用资源,变废为宝实验小组探究利用废旧印刷电路板来制备胆矾,具体流程如图所示:
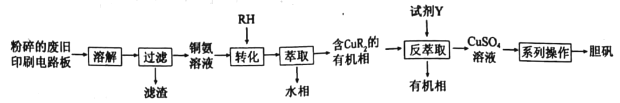
请回答:
(1)“溶解”过程中,为选择合适的溶解试剂,查阅资料后,小组同学设计如下实验。
实验编号 | 铜片质量/g | 试剂及用量 | 现象 |
1号 | 0.5 | 30%H2O250mL、蒸馏水8mL | 10h后,溶液变为浅蓝色,铜片表面附着蓝色沉淀 |
2号 | 0.5 | 30%H2O250mL、5mol·L-1H2SO48mL | 开始铜片表面有气泡生成(先慢后快,40min后,溶液蓝色明显铜片表面光亮 |
3号 | 0.5 | 30%H2O250mL、5mol·L-1氨水8mL | 立即产生大量气泡溶液为深蓝色,铜片表面附着少量蓝色沉淀 |
注:深蓝色溶液为铜氨溶液。
①1号实验中发生反应的化学方程式为______________。
②实验室检验2号实验中产生气体的操作和现象为______________。
③与2号实验相比,3号实验的优点是生成了铜氨配合物,加快了反应速率;其不足之处为______________。
④为弥补3号实验的不足,该小组继续进行改进,设计了4号实验(见下表,并得到了预期的实验现象。
实验编号 | 铜片质量/g | 试剂及用量 | 现象 |
4号 | 0.5 | 30%H2O250mL5mol·L-1氨水8mL和适量试剂X | 立即产生大量气泡,溶液为深蓝色,铜片表面仍光亮 |
则4号实验中,试剂x应为______________。
(2)“转化”时铜氨溶液中的Cu(NH3)42+与有机物RH发生反应的离子方程式为______________。“反萃取”过程中,所加试剂Y的化学式为______________。
(3)“系列操作”具体指_____________(填选项字母)。
A.蒸发浓缩、趁热过滤、洗涤、干燥
B.蒸发浓缩至溶液表面出现晶膜后停止加热,冷却、过滤、洗涤、干燥
C.蒸发浓缩至大量晶体析出后停止加热,冷却、过滤、洗涤、干燥
(4)为测定铜氨溶液中铜元素的含量,可采用如下方法:
i.移取500mL铜氨溶液于锥形瓶中,滴加稀H2SO4,调节溶液的pH为3-4
ⅱ.加入适当过量的KI溶液,并加入3mL0.5%淀粉溶液(![]() );
);
ⅲ.用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准液体积为5.80mL(I2+2S2O32-=2I-+S4O262-)。
①iii中滴定至终点时,溶液的颜色变化为______________。
②该铜氨溶液中铜元素的含量为______________g·mL-1(保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com