
【题目】下列离子方程式正确的是( )
A. 钠与水反应:Na+2H2O===Na++2OH-+H2↑
B. 硫酸铜溶液与氢氧化钡溶液反应:SO![]() +Ba2+===BaSO4↓
+Ba2+===BaSO4↓
C. 碳酸钙与稀盐酸反应:CO![]() +2H+===H2O+CO2↑
+2H+===H2O+CO2↑
D. 向FeCl3溶液中加入氨水:Fe3++3NH3·H2O===Fe(OH)3↓+3NH![]()
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案科目:高中化学 来源: 题型:
【题目】已知:H2A为二元弱酸,25℃时,在0.1mol/L 50 mL的H2A溶液中,H2A、HA-、A2-的物质的量浓度随溶液pH变化的关系如图所示(注:溶液的pH用NaOH固体调节,体积变化忽略不计)。

下列说法不正确的是
A. 在 pH = 3 时,c(HA-)>c(A2-)>c(H2A)
B. 在pH在0~7中,c(HA-)+c(A2-)+c(H2A)=0.1mol/L
C. 在pH 3→6的过程中,主要发生反应HA-+OH-==A2-+ H2O
D. 在 pH = 4.3 时,c(Na+)+c(H+)=c(OH-) + 2c(HA-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果.设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,
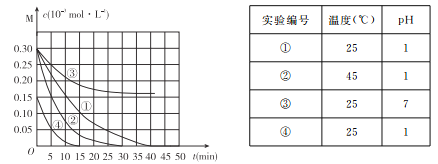
下列说法不正确的是
A. 实验①在15 min内M的降解速率为1.33×10-5mol/(L·min)
B. 若其他条件相同,实验①②说明升高温度,M降解速率增大
C. 若其他条件相同,实验①③证明pH越高,越不利于M的降解
D. 实验④说明M的浓度越小,降解的速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、钠、氯、铁等元素形成的单质及化合物在社会生活中应用广泛。请完成下列有关问题:
(1)工业用氯气与消石灰生产漂白粉,漂白粉的有效成分在水溶液中的电离方程式为______ 。
(2)氯化亚铁溶液中滴入几滴KSCN溶液无明显变化,再滴加少最氯水溶液变成红色,写出该变化过程中的化学方程式,开标出电子转移的方向与数目:______ 。
(3)实现C2O42-→CO2的转化必须加入______ (选填:氧化剂、还原剂、酸)。
(4)一个钠离子的质量为______ (保留三位有效数宁)。
(5)CO、CO2、O3(臭氧)三种气体,含有的氧原子数相等,则三种气体在同温同压下的体积比为______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与外界隔热、容积不变的密闭容器中.发生2X(g) + Y(g)![]() 3Z(g) + M(s) △H=-akJ/mol,下列说法不正确的是
3Z(g) + M(s) △H=-akJ/mol,下列说法不正确的是
A. 容器的温度不再升高,表明反应达到平衡状态
B. 容器压强不变,表明反应达到平衡状态
C. 达到化学平衡时,反应放出的总热量可能为akJ
D. 反应过程中,气体的密度始终保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一瓶久置的Na2SO3固体试剂,已部分变质,为测定其纯度,实验设计与操作如下,请回答问題:
(1)Na2SO3变质的原因(用化学方程式表示)___________。
(2)取一定量的样品溶于水,加入过量的BaCl2溶液,然后过滤(如图)、洗涤、干燥、称量,其中洗涤沉淀的具体操作为___________。
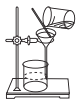
(3)实验时用BaCl2比用CaCl2好,写出两点理由:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数约为6.02×1023/mol,下列说法一定正确的是( )
A. 60gSiO2晶体中,约含有2×6.02×1023个Si-O键
B. 78gNa2O2晶体中约有2×6.02×1023个阴离子
C. 720g C60晶体约含有6.02×1023个如图中晶胞单元

D. 14g两种烯烃CnH2n和CmH2m混合物,含有共用电子对数目约为3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E正一价阳离子M能层电子己排满。D与B可形成离子化合物其晶胞结构如图所示。请回答下列问题:
(1)E元素原子基态时的价电子排布图为___________;
(2)A2F分子中F原子的杂化类型是_______,F的氧化物FO3分子空间构型为______;
(3)CA3极易溶于水,其原因主要是________,试判断CA3溶于水后形成CA3·H2O的合理结构________(填字母代号),从氢键的形成角度回答推理依据是:___________。
(a) (b)
(b)
(4)E的晶胞常采取________堆积方式。
(5)从图中可以看出,D跟B形成的离子化合物的化学式为_________;该离子了化合物晶体的密度为ag/cm3,则晶胞的体积是_______cm3(写出表达式即可,NA表示阿伏加德罗常数的值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com