
分析 (1)根据中和滴定有检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等操作;
(2)滴定时,眼睛注意观察溶液颜色变化;
(3)用酚酞为指示剂,滴定终点溶液由颜色变为浅红色,且半分钟不褪色;
(4)a.滴定管用蒸馏水洗涤后,应先润洗;
b.随着NaOH溶液滴入,溶液中氢离子浓度不断减小;
c.滴定终点溶液颜色由无色变为浅红色;
d.滴定达终点滴定管尖嘴部分有悬滴,所用标准液体积偏大;
e.滴定结束后若仰视观察滴定管中液面刻度,则体积偏大;
(5)含有KOH,碱的物质的量浓度偏小;
(6)将5.00mL甲醛水溶液加入到经调至中性的亚硫酸钠溶液中,充分反应后,得到溶液中含有NaOH,由硫酸的物质的量可得NaOH,以此确定甲醛的物质的量,进而计算浓度;若滴定管规格为50mL,如硫酸全部反应,体积为50mL,则可知消耗硫酸的物质的量,可知需要甲醛的物质的量,结合其浓度,可确定体积.
解答 解:(1)中和滴定按照检漏、洗涤、润洗、装液、排气泡,读数等操作,顺序操作,则正确的顺序为CABED,
故答案为:CABED;
(2)滴定时,左手挤压玻璃球,右手不断摇动锥形瓶,眼睛注意观察溶液颜色变化,以判断滴定终点,故答案为:注意观察溶液颜色变化;
(3)本实验是用NaOH滴定盐酸溶液,用酚酞作指示剂,所以终点时现象:当溶液由无色变为浅红色,且在半分钟内不褪色;
故答案为:当溶液由无色变为浅红色,且在半分钟内不褪色;
(4)a.滴定管用蒸馏水洗涤后,应先润洗,然后再装入NaOH溶液进行测定,故a错误;
b.随着NaOH溶液滴入,溶液中氢离子浓度不断减小,则锥形瓶中溶液pH由小变大,故b正确;
c.用酚酞作指示剂,滴定终点溶液颜色由无色变为浅红色,故c错误;
d.滴定达终点时,发现滴定管尖嘴部分有悬滴,所用标准液体积偏大,则测定结果偏大,故d正确;
e.滴定结束后若仰视观察滴定管中液面刻度,则体积偏大,测定结果偏大,故e错误.
故答案为:bd;
(5)含有KOH,碱的物质的量浓度偏小,需要溶液体积偏大,则测定结果偏高,故答案为:偏高;
(6)产生的氢氧化钠的物质的量与甲醛的物质的量相等,n(H2SO4)=1.000mol•L-1×0.0248L=0.0248mol,将5.00mL甲醛水溶液加入到经调至中性的亚硫酸钠溶液中,充分反应后,得到溶液中含有NaOH,加入硫酸发生反应:H2SO4+2NaOH=Na2SO4+2H2O,则n(HCHO)=n(NaOH)=2n(H2SO4)=0.0248mol×2=0.0496mol,c(HCHO)=$\frac{0.0496mol}{0.005L}$=9.92mol/L;
若滴定管规格为50mL,如硫酸全部反应,体积为50mL,则可知消耗硫酸的物质的量为0.05L×9.92mol/L=0.496mol,则n(HCHO)=n(NaOH)=2n(H2SO4)=0.992mol,甲醛水溶液取样不能超过的体积为V=$\frac{0.992mol}{9.92mol/L}$=0.1L=100mL,
故答案为:9.92;100.
点评 本题以甲醛为载体综合考查物质的含量测定,为高频考点,侧重于学生的分析能力、实验能力和计算能力,有利于培养学生良好的科学素养,提高学习的积极性,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | A | B | C |
| 装置 | 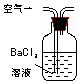 | 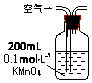 | 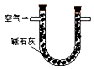 |
| 原理 | 通入V升空气,测定生成沉淀的质量 | 当KMnO4溶液刚好褪色时,测定通入空气的体积V | 通入V升空气,测定U型管增加的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n(CO2)/mol | 0 | 1 | 3 | 1 |
| n(H2)/mol | 0 | 2 | 2 | 1 |
| n(CO)/mol | 3 | 0.5 | 1 | 2 |
| n(H2O)/mol | 3 | 2 | 5 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 测定次数 | 收集前读数/mL | 收集后读数/mL |
| 第1次 | 21.06 | 4.24 |
| 第2次 | 23.52 | 6.72 |
| 第3次 | 22.41 | 5.63 |
| 第4次 | 20.80 | 7.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com