
【题目】某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.
(1)该反应的离子方程式为 __________________________________ .
实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01molL-1、0.001molL-1,每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.1molL-1)的用量均为2mL.在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):
KMnO4酸性溶液的浓度/molL-1 | 溶液褪色所需时间t/min | ||
第1次 | 第2次 | 第3次 | |
0.01 | 14 | 13 | 11 |
0.001 | 6 | 7 | 7 |
(2)计算用0.001molL-1KMnO4酸性溶液进行实验时KMnO4的平均反应速率___________________________ (忽略混合前后溶液的体积变化).
(3)若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行? _____________________ .(填“行”或“不行”)
【答案】2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O0.0001mol/(L·min)不行
【解析】
(1)高锰酸钾具有强氧化性,能将草酸氧化为二氧化碳,本身被还原为锰离子,离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)反应开始时:c(KMnO4)=![]() =0.00067molL-1,反应时间:△t=
=0.00067molL-1,反应时间:△t=![]() =6.7min,KMnO4的平均反应速率v(KMnO4)=
=6.7min,KMnO4的平均反应速率v(KMnO4)=![]() =
=![]() =1×10-4mol/(Lmin),故答案为:1×10-4mol/(Lmin);
=1×10-4mol/(Lmin),故答案为:1×10-4mol/(Lmin);
(3)由题中数据知浓度大的褪色时间反而长,因颜色是由KMnO4产生,虽然KMnO4浓度大反应快,但KMnO4的量也多,故无法比较,故不经过计算直接利用表中的褪色时间长短来判断浓度大小与反应速率的关系是不可行的,故答案为:不行。


科目:高中化学 来源: 题型:
【题目】四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4,同时获得副产品甲的工业生产流程如下:
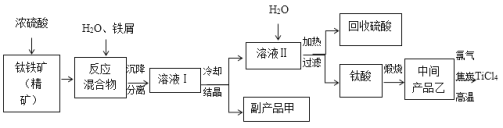
(1)已知酸浸反应FeTiO3+2H2SO4===FeSO4+TiOSO4+2H2O,则FeTiO3中铁元素的化合价为___________。
(2)上述生产流程中加入铁屑的目的是使Fe3+还原为Fe2+,且反应得到的溶液中含钛元素的离子只有TiO2+,该过程发生的主要反应有:
①2Fe3++Fe===3Fe2+ ; ②2TiO2++Fe+4H+===2Ti3++Fe2++2H2O;③______________________________________。
(3)加热TiOSO4溶液可制备TiO2·nH2O胶体,其反应的化学方程式为__________________。
(4)由TiO2·nH2O胶体制得固体TiO2·nH2O,再用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+![]() Fe3++3H2O的平衡常数K=___________________。
Fe3++3H2O的平衡常数K=___________________。
(5)可循环利用的物质是_________,副产品甲含结晶水,其化学式是_______________。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用___________方法。
TiCl4 | SiCl4 | |
熔点/℃ | -25.0 | -68.8 |
沸点/℃ | 136.4 | 57.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法正确的是
A. 162g淀粉和纤维素混合物中氧原子的数目为5NA
B. 常温时,pH=5的盐酸中水电离的OH-数目为10-9NA
C. 5mol的CH3COONa固体溶于水所得溶液中CH3COO-数目为5NA
D. 22.4L Cl2与足量的铁反应,转移的电子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )
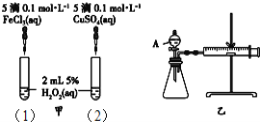
A. 实验中H2O2分解的速率为(1)>(2)
B. 图乙实验可通过测定相同状况下,产生的气体体积与反应时间来比较反应速率
C. H2O2分解的热化学方程式2H2O2(l)═2H2O(l)+O2(g)△H>0
D. 图甲中(1)、(2)两个实验中H2O2分解的△H相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO(g)与H2O(g)反应的能量变化如图所示,有关两者反应的说法正确的是( )

A. 该反应为吸热反应
B. 该反应不需要加热就能进行
C. 1 molCO(g)和1mol H2O(g)具有的总能量大于1 molCO2(g)和1 molH2(g)具有的总能量
D. 1 molCO2(g)和1 molH2(g)反应生成1 molCO(g)和1mol H2O(g)要放出41 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半导体工业需要高纯硅,粗硅中含有SiO2、Fe2O3、CuO、C等杂质,提纯硅的方法比较多,其中三氯氢硅(有一定毒性)氢还原法和四氯化硅氢还原法应用较为广泛,下面是实验室模拟工业上三氯氢硅氢还原法的基本原理:
已知:①Si+3HCl ![]() SiHCl3+H2(主要反应)
SiHCl3+H2(主要反应)
Si+4HCl![]() SiCl4+2H2(次要反应)
SiCl4+2H2(次要反应)
2NaCl+H2SO4(浓)![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
②典型硅的重要化合物的部分性质如下表:
熔点(℃) | 沸点(℃) | 溶解性 | |
SiHCl3 | -127 | 33 | 易溶于多数有机溶剂 |
SiCl4 | -23 | 77 | 易溶于多数有机溶剂 |
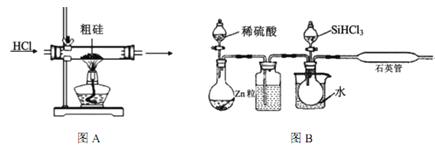
(1)粗硅在提纯前,需要进行酸、碱预处理,其目的是___________________________________。
(2)下列装置在实验室可用于制备HCl气体的是_____(填字母代号)。
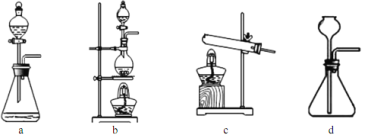
(3)在1100~1200℃条件下,利用图B在石英管中可以获得硅,写出该反应的方程式_______;其烧杯中水的作用是__________________________;该装置使用石英管而不是普通玻璃管的原因是_________。
(4)三氯氢硅氢还原法用 SiHCl3在图B中制硅,不足之处有_______________(任意回答一点即可)。
(5)SiCl4与氢气反应也能得到硅,但反应所需温度不同,在工业上往往将三氯氢硅中混入的SiCl4分离后再与氢气反应,你认为最好的分离方法是______________。
(6)工业上如果用四氯化硅氢还原法制硅,其原理如下:![]() 该方法与用三氯氢硅氢还原法比较,其缺点至少有两处,分别是_________________。
该方法与用三氯氢硅氢还原法比较,其缺点至少有两处,分别是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要配制2 mol/L的NaCl溶液950 mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
A. 950 mL,111.2 g B. 500 mL,117 g
C. 1 000 mL,117 g D. 1 000 mL,111.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图![]() 为直流电源,
为直流电源,![]() 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,![]() 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现![]() 上的c点显红色,为实现铁上镀锌,接通
上的c点显红色,为实现铁上镀锌,接通![]() 后,使c、d两点短路.下列叙述正确的是
后,使c、d两点短路.下列叙述正确的是
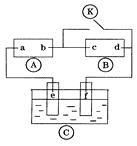
A. a为直流电源的负极
B. c极发生的反应为2H++2e-=H2↑
C. f电极为锌板
D. e极发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下图所示:
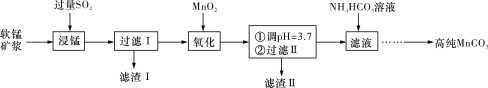
(1)“过滤Ⅰ”所得“滤渣Ⅰ”的主要成分为_________(填化学式)。
(2)“氧化”过程中除了发生MnO2与SO2的反应外,还发生另一氧化还原反应,写出该反应的离子方程式______________________________________________________________。
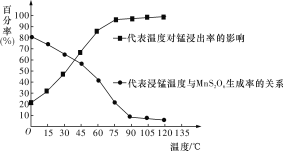
(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是____________________________________。
(4)向“过滤Ⅱ”所得的滤液中加入NH4HCO3溶液时温度控制在30~35 ℃,温度不宜太高的原因是_________________________________________________________________。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有CO2气体生成,写出反应的离子方程式:_____________________________________________________________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验沉淀是否洗涤干净的方法是___________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com