
【题目】一个集气瓶中放有一团棉花,向其中倒入CO2气体时棉花燃烧起来,则棉花中可能包有
A. 烧碱 B. 氧化钠
C. 过氧化钠 D. 小苏打
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在一点条件下,RO3n-+F2+aOH-=RO4- +2F-+H2O,下列叙述正确的是( )
A.n=2,a=2B.n=2,a=1
C.RO3n-中R的化合价为+6D.n=1,a=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性无色溶液中,可以大量共存的离子组是( )
A.Na+、K+、CO32-、Cl-B.Al3+、K+、SO42-、Cl-
C.K+、Cu2+、Cl-、NO3-D.K+、Ag+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,你认为下列叙述正确的是( )
A.同周期元素原子的最外层电子数相同
B.在周期表中,最外层电子数为1的元素都是金属元素
C.在周期表中,第18列元素的化学性质很稳定
D.ⅦA族元素容易失去电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用AG表示溶液中的![]() 。25℃时,用0.100 mol/L 的NaOH溶液滴定20.00 mL 0.100mol/L的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是
。25℃时,用0.100 mol/L 的NaOH溶液滴定20.00 mL 0.100mol/L的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是

A. 随着NaOH溶液的加入,![]() 增大
增大
B. 25 ℃时,HNO2的电离常数Ka≈1.0×![]()
C. b点溶液中存在![]()
D. a、b、c、d、e五点的溶液中,水的电离程度最大的点是d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol·L-1的H2SO4溶液中,乙同学将电极放入6mol·L-1的NaOH溶液中,如图所示。
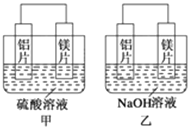
(1)甲中SO42-移向________极(填“铝片”或“镁片”)。写出甲中负极的电极反应式____________。
(2)乙中负极为________,总反应的离子方程式:_______________。此反应中氧化剂和还原剂的物质的量之比为________,还原产物是________。
(3)原电池是把______________的装置。上述实验也反过来证明了“直接利用金属活动性顺序表判断原电池中的正负极”这种做法________(填“可靠”或“不可靠”)。如不可靠,请你提出另一个判断原电池正负极的可行性实验方案________(如可靠,此空可不填)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe2+的简化电子排布式为____________________。
(2)实验室可用KSCN、苯酚( )来检验Fe3+ 。N、O、S三种元素的第一电离能由大到小的顺序为 _______________(用元素符号表示),苯酚中碳原子的杂化轨道类型为_________。
)来检验Fe3+ 。N、O、S三种元素的第一电离能由大到小的顺序为 _______________(用元素符号表示),苯酚中碳原子的杂化轨道类型为_________。
(3)FeCl3的熔点为306 ℃,沸点为315 ℃。FeCl3的晶体类型是_____________ 。FeSO4常作净水剂和补铁剂,SO42- 的立体构型是___________________。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1 mol Fe(CO)5分子中含______molσ键,与CO互为等电子体的离子是 _________________(填化学式,写一种)。
(5)氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为________。
(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg/cm3 ,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为 ________ ;Fe2+与O2-最短核间距为 __________ pm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒的物质的量分数δ随溶液pH的变化曲线如下图所示:下列说法正确的是:

A. 曲线1和曲线2分别表示8(H3PO4)和6(HPO42-)的变化
B. 25℃时,H3PO4的电离常数K1=10-2.1
C. pH=7.2时,溶液中c(H2PO4ˉ)+c(HPO42-)+c(OHˉ)=c(Na+)+c(H+)
D. pH=12.3时,溶液中由水电离出的c(H+)=10-12.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列方法制取氢气,反应速率最大的是( )
A.冬天,块状锌与2 molL﹣1硫酸溶液反应
B.冬天,粉末状锌与2 molL﹣1硫酸溶液反应
C.夏天,块状锌与2 molL﹣1硫酸溶液反应
D.夏天,粉末状锌与2molL﹣1硫酸溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com