
| m |
| n |
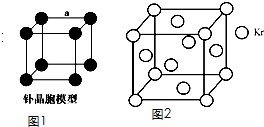
| 1 |
| 8 |
| 1 |
| 2 |
| 942-247 |
| 2 |
| 209 |
| NA |
| m |
| V |
| ||
| a3cm3 |
| 3 |
| ||
| 3 |
| ||
| 1 |
| 8 |
| 1 |
| 2 |
| m |
| n |
| 12 |
| 4 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H++HCO3-═H2O+CO2↑ |
| B、2HSO4-+CO32-═H2O+CO2↑+2SO42- |
| C、HSO4-+HCO3-═H2O+CO2↑+SO42- |
| D、2H++CO32-═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4 |
| B、CrO3 |
| C、Cr2(SO4)3 |
| D、C2H50H |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
| C、2.5dmol/L | ||
| D、1.25dmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn与稀H2SO4 |
| B、NaCl溶液与AgNO3溶液 |
| C、H2与O2 |
| D、Na2O与H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.112L |
| B、1.12L |
| C、0.224L |
| D、2.24L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com