
 ,F为Cu元素,原子核外有29个电子,原子的电子排布式是1s22s22p63s23p63d104s1,
,F为Cu元素,原子核外有29个电子,原子的电子排布式是1s22s22p63s23p63d104s1, ;1s22s22p63s23p63d104s1;
;1s22s22p63s23p63d104s1;| 4+2 |
| 2 |
| 5+3 |
| 2 |
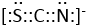 ,
,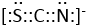 ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、[Cr(H2O)6]Cl3 |
| B、[Cr(H2O)5Cl]Cl2 |
| C、[Cr(H2O)4Cl2]Cl |
| D、[Cr(H2O)3Cl3] |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、H+、SO42-、OH- |
| B、K+、Ca2+、CO32-、NO3- |
| C、Na+、H+、Cl-、CO32- |
| D、K+、Cu2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、难溶电解质的Ksp越小,溶解度就一定越小 |
| B、一般认为沉淀离子浓度小于1.0×10-5 mol/L时,沉淀就达完全 |
| C、用饱和Na2CO3溶液可以将BaSO4转化为BaCO3,说明Ksp(BaCO3)小于Ksp(BaSO4) |
| D、向含AgCl沉淀的悬浊液中加入NaCl饱和溶液,AgCl的溶解度变小,溶度积常数变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| m |
| n |
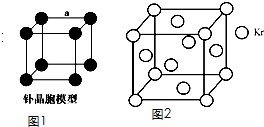
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com