
| A、不能使溴水因反应褪色 |
| B、能使酸性KMnO4溶液褪色 |
| C、与Cl2发生取代反应 |
| D、可以在空气中燃烧 |


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶解 |
| ① |
| BaCl2 |
| ② |
| NaOH |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量盐酸 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
| 分离酒精和水 | 分离水和 汽油 | 称取一定质量的NaOH | 分离氯化钠和 硝酸钾 |
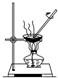 |  | 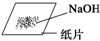 (天平及托盘略) | 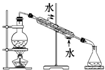 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯的同系物分子中的碳原子数比苯分子中的碳原子数多 |
| B、苯环受侧链影响易被氧化 |
| C、侧链受苯环影响易被氧化 |
| D、苯环上有三个双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MgO、Al2O3的熔点很高,可制作耐高温材料,工业上也用其电解冶炼对应的金属 |
| B、明矾水解形成的胶体能吸附水中悬浮物,可用于水的净化 |
| C、燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 |
| D、铝比铁活泼,但铝制品比铁制品在空气中耐腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
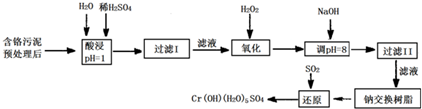
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com