
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |


科目:高中化学 来源: 题型:
| A、①② | B、③④ | C、①③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属晶体具有良好的延展性,是因为金属晶体中的原子层在滑动过程中金属键未破坏 |
| B、电子云图象中黑点的疏密是指电子数的多少 |
| C、含有极性键的分子一定是极性分子 |
| D、键能越大,表示该分子越容易受热分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:

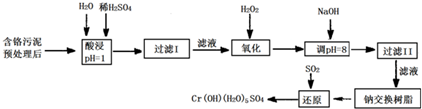
查看答案和解析>>
科目:高中化学 来源: 题型:

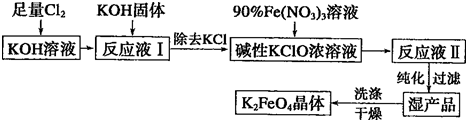
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、[Cr(H2O)6]Cl3 |
| B、[Cr(H2O)5Cl]Cl2 |
| C、[Cr(H2O)4Cl2]Cl |
| D、[Cr(H2O)3Cl3] |
查看答案和解析>>
科目:高中化学 来源: 题型:
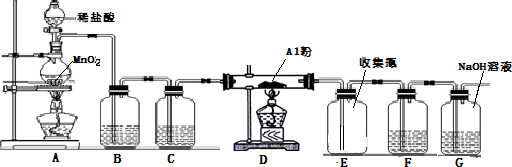
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com