



 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
| A、苯的同系物分子中的碳原子数比苯分子中的碳原子数多 |
| B、苯环受侧链影响易被氧化 |
| C、侧链受苯环影响易被氧化 |
| D、苯环上有三个双键 |
查看答案和解析>>
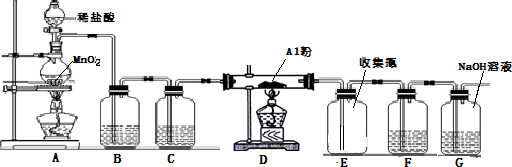
科目:高中化学 来源: 题型:
| 实验编号 | NaOH溶液的浓度 (mol/L) | 消耗NaOH溶液的 体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 19.98 | 20.00 |
| 2 | 0.10 | 20.02 | 20.00 |
| 3 | 0.10 | 20.00 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
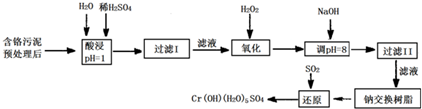
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:
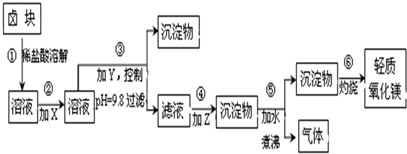
| 表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6﹡ | b.双氧水(含30%H2O2) | 2400 |
| Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2100 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 600 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学购买了一瓶××牌“84消毒液”,查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO1000mL、密度1.19g?cm-3.
某同学购买了一瓶××牌“84消毒液”,查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO1000mL、密度1.19g?cm-3.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室制备有毒气体应在通风橱中进行,且必须对尾气进行吸收或处理 |
| B、浓硝酸需用细口棕色试剂瓶密封保存 |
| C、氢气还原氧化铜,一般先预热氧化铜,然后通入氢气 |
| D、高锰酸钾等药品不能和易燃物同放,且远离火源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com