
����Ŀ��ij��ѧ��ȤС����ͼ��װ���Ʊ�����������������һϵ��ʵ�顣
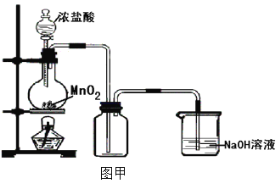
(1)ʵ�����Ʊ������ķ�Ӧԭ����_______________________
(2)����87gMnO2�μӷ�Ӧ,���������Ȼ�������ʵ���Ϊ____________����ʵ���ռ����������DZ�����ֵС����д������ܵ�һ��ԭ��____________
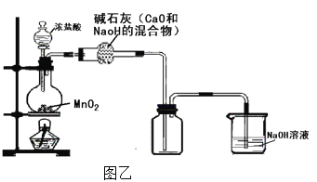
(3)��ͬѧ��Ϊͼ��װ���Ʊ������������������л���HCl�����ˮ��������װ�ý�������ͼ�ҸĽ�������Ϊ������____________ (���������롰���������֣��粻������������˵������)
(4)��ͼ��װ�ú�����װ����ȡ���ռ�һƿ�����������ȵ���˿�嵽���������ļ���ƿ�У�������˿�������м���ȼ�գ��ڼ���ƿ�ڳ�����ɫ���̣��̵ijɷ�Ϊ��Ӧ����ʽΪ____________
(5)���ռ�һƿ�������ڼ���ƿ�м���ˮ���۲쵽Һ��Ϊdz����ɫ���д������ԭ����____________������Һ�ֳ����ݣ��ֱ����һ-������������Һ��д����Ӧ�ķ���ʽ:
Na2CO3��Һ____________
AgNO3��Һ____________
KI��Һ____________
(6)��ʵ����������������ɢ���������У�����Ʒ����������____________
���𰸡�MnO2+4HCl(Ũ) ![]() MnCl2+Cl2��+2H2O 2mol HCl�ӷ���Cl2��������ˮ ���������������������Ʒ�Ӧ FeCl3��2Fe + 3Cl2
MnCl2+Cl2��+2H2O 2mol HCl�ӷ���Cl2��������ˮ ���������������������Ʒ�Ӧ FeCl3��2Fe + 3Cl2![]() 2FeCl3 Cl2 + H2O
2FeCl3 Cl2 + H2O ![]() HCl + HClO Na2CO3 + 2HCl = 2NaCl + CO2��+ H2O AgNO3 + HCl = AgCl��+ HNO3 2KI + Cl2 = KCl + I2 ��ʪ��⻯����ֽ����ʵ�����У�����ֽ������������������ɢ����������
HCl + HClO Na2CO3 + 2HCl = 2NaCl + CO2��+ H2O AgNO3 + HCl = AgCl��+ HNO3 2KI + Cl2 = KCl + I2 ��ʪ��⻯����ֽ����ʵ�����У�����ֽ������������������ɢ����������
��������
��1���������̺�Ũ�����ϼ��ȿ����Ʊ��������ݴ�д������ʽ��
��2��MnO2+4HCl(Ũ) ![]() MnCl2+Cl2��+2H2O��Ӧ�У���������HClΪ2mol������HCl��ӷ���������������ˮ���ᵼ����������С������ֵ��
MnCl2+Cl2��+2H2O��Ӧ�У���������HClΪ2mol������HCl��ӷ���������������ˮ���ᵼ����������С������ֵ��
��3����������������Ʒ�Ӧ��
��4����˿��������ȼ�������Ȼ�����
��5�������м���ˮ����ˮ������Ӧ���ɴ�������Ȼ��⣻��ˮ�к������ᣬ��̼������Һ����������Һ��Ӧ����ˮ�е���������⻯����Һ��Ӧ�����Ȼ��غ͵ⵥ�ʣ��ݴ�д������ʽ��
��6���������������ԣ��ܹ��ѵ����������ⵥ�ʣ�������������������ݴ����ʽ��������ļ��顣
��1��ʵ����ͨ���������̺�Ũ�����ϼ����Ƶ���������Ӧԭ����MnO2+4HCl(Ũ) ![]() MnCl2+Cl2��+2H2O��
MnCl2+Cl2��+2H2O��
��2��87gMnO2Ϊ1Ħ������������HClռ�μӷ�Ӧ��һ�룬���ݷ�Ӧ����ʽMnO2+4HCl(Ũ) ![]() MnCl2+Cl2��+2H2O��֪����������HClΪ2mol����Ӧ������HCl��ӷ�һ���ֵ�����������С������ֵ��Ҳ�п�����������������ˮ������ȷ���ǣ�2mol��HCl�ӷ���Cl2��������ˮ��
MnCl2+Cl2��+2H2O��֪����������HClΪ2mol����Ӧ������HCl��ӷ�һ���ֵ�����������С������ֵ��Ҳ�п�����������������ˮ������ȷ���ǣ�2mol��HCl�ӷ���Cl2��������ˮ��
��3������������Ϊ��������������Ʒ�Ӧ����������������һ���ֱ������������գ��ʴ��ǣ����������������������Ʒ�Ӧ
��4����˿��������ȼ�������Ȼ���������ʽΪ��2Fe + 3Cl2![]() 2FeCl3������ȷ���ǣ�FeCl3��2Fe + 3Cl2
2FeCl3������ȷ���ǣ�FeCl3��2Fe + 3Cl2![]() 2FeCl3��
2FeCl3��
��5�������м���ˮ����ˮ������Ӧ���ɴ�������Ȼ��⣬��Ӧ�Ļ�ѧ����ʽΪ��Cl2+H2OHCl+HClO����ˮ�ʻ���ɫ����ˮ�е��������̼������Һ��Ӧ�����Ȼ��ơ�ˮ�Ͷ�����̼����ѧ����ʽΪ��Na2CO3+2HCl=2NaCl+CO2��+H2O����ˮ�е����������������Һ��Ӧ�����Ȼ��������ᣬ��ѧ����ʽΪ��AgNO3+HCl=AgCl��+HNO3����ˮ�е���������⻯����Һ��Ӧ�����Ȼ��غ͵ⵥ�ʣ���ѧ����ʽΪ��2KI+Cl2=KCl+I2��
��6���������������ԣ��ܹ��ѵ����������ⵥ�ʣ��������������������ʪ��⻯����ֽ����ʵ�����У�����ֽ������������������ɢ���������С�


 ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д�
ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д� â���̸����������������ϵ�д�
â���̸����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش���������
��1����ƽ���·���ʽ
__K2Cr2O7+__HC1=__KC1+__CrCl3+__H2O+__Cl2��
��2�����Ϸ�Ӧ��ʧ���ӵ�������__����ԭ������__��ÿ����lmol���ֻ�ԭ�������__mol���ӷ���ת�ơ��������뻹ԭ�������ʵ���֮��Ϊ___��
��3����֪��Ӧ��2H2S+H2SO3=2H2O+3S��������������Ȼ�ԭ�����1.6g����ͬʱ������ˮ������Ϊ___g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����nAΪ����٤����������ֵ������˵����ȷ����
A. 23g Na ������H2O��Ӧ��ȫ�������nA��H2����
B. 1 molCu��������Ũ���ᷴӦ������nA��SO3����
C. ��״���£�22.4L N2��H2������к�nA��ԭ��
D. 3mol����Fe��ȫת��ΪFe3O4��ʧȥ8nA������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ��(������������ȥ)�ش������й����⡣
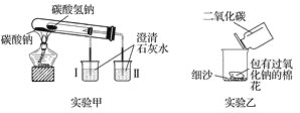
(1)ʵ����ڼ��ȹ������ܹ۲쵽������ɫ�������ձ���________(����������������)�����ձ��з�����Ӧ�����ӷ���ʽ��________��ͨ��ʵ���֤��______(����Na2CO3������NaHCO3��)���ȶ���
(2)ʵ��������̽��Na2O2��CO2�ķ�Ӧ���۲쵽��ʵ������Ϊ����Na2O2�����Ż�д��Na2O2��CO2��Ӧ�Ļ�ѧ����ʽ��_________�����Ż�˵���÷�Ӧ���ص���_________
(3)ȡ10 g̼���ƺ�̼�����ƵĻ�����ּ��ȣ������ɵ�CO2����ͨ�������ij���ʯ��ˮ�У�������ɳ���������Ϊ4.0 g����ԭ�������̼���Ƶ���������Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(CN)2��(SCN)2��(OCN)2������±��������±�ص��ʵ��������ƣ���������������Ҳ���ƣ��磺2Fe + 3(SCN)2="==" 2Fe(SCN)3��2Fe + 3Cl2="==" 2FeCl3���Դ��ж����л�ѧ����ʽ�д������
A.(CN)2+ H2O![]() HCN + HCNO
HCN + HCNO
B.(SCN)2+ 2Cu![]() 2CuSCN
2CuSCN
C.(OCN)2+ 2NaOH ="==" NaOCN + NaOCNO + H2O
D.MnO2+ 4HSCN(Ũ)![]() (SCN)2 + Mn(SCN)2+ 2H2O
(SCN)2 + Mn(SCN)2+ 2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������к���ԭ���������ǣ� ��
A.1molH2B.0.3molNH3C.6.02��1024��CH4����D.18g��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���� �� ��
A.�����ӵ���������ָ6.02��1023
B.3.01��1023��Na+�е��ӵ����ʵ�����5 mol
C.1 mol�κ����������е�ԭ��������ͬ
D.2 mol SO42��Լ����1.204��1023��SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ��С��������245mL 0.1mol/L����������Һ��ʵ���������������Լ�����FeSO4��7H2O����5mol/LFeSO4��Һ���ַ���С��ֱ����ʵ�飬��һС��ѡ���Լ��٣��ڶ�С��ѡ���Լ��ڡ�
��1����һС������Լ��ٵ�����Ϊ__________g��
��2���ڶ�С�龭������Ҫ______mL5mol/LFeSO4��Һ,����ȡ�Լ��ں��������в�����
a.��ϡ�͵���Һ���¶�������һ�º��ز�����ע������ƿ�С�
b. ________ʹ��Һ��Һ����ƿ���Ŀ̶ȱ������С�
c.��ʢFeSO4��Һ���ձ���ע������ˮ�����ò�����������ʹ���Ͼ��ȡ�
d.������ˮϴ���ձ��Ͳ�����2��3�Σ�����ϴ��Һȫ��ע������ƿ��
���������У���ȷ��˳����(�����)____________������ȡ����Ũ���ᣬ������c��ʵ��ľ���������裺________
��3�����������ƹ����У��������������������ҺŨ���к�Ӱ�죿
A ����Ͳ��ȡ�Լ���ʱ���ӹ۲찼Һ�档
B ϡ�͵�FeSO4��Һδ�ָ������£��ز�����ע������ƿ�С�
C δ������ˮϴ���ձ��Ͳ�������
D ����ʱ�����ӹ۲찼Һ�档
E ���ݺ������ƿ����ҡ�ȣ�����Һ����ڿ̶��ߣ��ּ�ˮ���̶��ߡ�
F ������Һʱ������ƿ��������ˮ��
ƫ�ߣ�______________ ƫ�ͣ�____________ ��Ӱ�죺_____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��д�����л��ţ�������ţ������ƻ�ṹ��ʽ��
��CH2CH3_______����Br_______��̼̼������_______����������
��2����ϩ�Ŀռ乹�͡�_______����������
��3����Ȳ�ĵ���ʽ_______������������
��4������ͬϵ���ͨʽ_______������������
��5��![]() ����ʽ��_______������������
����ʽ��_______������������
��6��![]() �䱽���ϵ�һ�ȴ�����_______����
�䱽���ϵ�һ�ȴ�����_______����
��7��2��5��������4���һ����飨д���ṹ��ʽ����_______����������
��8��4��4��5��������2����Ȳ��д���ṹ��ʽ����_______����������
��9��![]() ��ϵͳ������_______������������
��ϵͳ������_______������������
��10��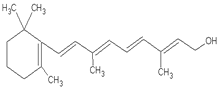 1mol����������_______molH2��_______molBr2����_______molNa
1mol����������_______molH2��_______molBr2����_______molNa
��11�����𱽣��⻯����Һ����������Һ����ϩ�����Ȼ�̼ʱ��ֻ����һ���Լ������Լ���_____��
��12��д��C5H8����Ȳ��������ͬ���칹��__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com