
【题目】回答下列问题
(1)配平以下方程式
__K2Cr2O7+__HC1=__KC1+__CrCl3+__H2O+__Cl2↑
(2)以上反应中失电子的物质是__,还原产物是__,每生成lmol这种还原产物,将有__mol电子发生转移。氧化剂与还原剂的物质的量之比为___。
(3)已知反应:2H2S+H2SO3=2H2O+3S↓,若氧化产物比还原产物多1.6g,则同时会生成水的质量为___g。
【答案】1 14 2 2 7 3 HCl CrCl3 3 1:6 1.8
【解析】
(1)分析反应中各元素化合价变化,依据氧化还原反应得失电子守恒,原子个数守恒配平方程式;
(2)反应物中所含元素化合价升高的为还原剂,对应氧化产物,所含元素化合价降低的反应物为氧化剂,对应还原产物;依据K2Cr2O7+14HCl(浓)=2KCl+2CrCl3+3Cl2↑+7H2O,可知生成3mol氯气转移6mol电子,被氧化的氯化氢物质的量为6mol;
(3)反应中H2S中S氧化化合价升高,SO2中S元素化合价降低,氧化产物为2mol,还原产物为1mol,此时氧化产物比还原产物多32g,据方程式计算。
(1)K2Cr2O7+HCl(浓)=KCl+CrCl3+Cl2↑+H2O,K2Cr2O7中+6价Cr化合价降为CrCl3中+3价,反应1molK2Cr2O7,得到6mol电子,HCl中-1价的Cl化合价升高为Cl2中的0价,生成1molCl2失去2mol电子,依据得失电子守恒可知:CrCl3系数为2,Cl2系数为3,然后根据反应前后各种原子个数相等配平,故方程式K2Cr2O7+14HC1=2KC1+2CrCl3+7H2O+3Cl2↑,故答案为:1;14;2;2;7;3;
(2)反应中K2Cr2O7中+6价Cr化合价降为CrCl3中+3价,所以K2Cr2O7为氧化剂,CrCl3为还原产物;HCl中-1价的Cl化合价升高为Cl2中的0价,所以HCl为还原剂,Cl2为氧化产物;依据
 ~6mole-
~6mole-
2 6
1 3
故电子转移3mol,从反应中得14HCl中有6HCl价态发生变化,还有8个未发生变化,故作还原剂的为6mol,氧化剂K2Cr2O7为1mol,故氧化剂与还原剂的物质的量之比为1:6,故答案为:HCl;CrCl3;3;1:6;
(3)反应2H2S+SO2=2H2O+3S↓中,生成3molS,氧化产物为2mol,还原产物为1mol,此时氧化产物比还原产物多32g,同时会生成水2mol,若氧化产物比还原产物多1.6g,同时会生成水0.1mol,质量是1.8g,故答案为:1.8。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是一种药物中间体,合成 G的部分流程如下:

请回答下列问题:
(1)G物质中的含氧官能团的名称是___________、____________。
(2)上述⑤变化过程的反应类型是_____________。
(3)反应A→B的化学方程式为________________________________________。
(4)写出满足下列条件的C的同分异构体的结构简式:_______________________。
Ⅰ. 苯环上只有两种取代基。
Ⅱ. 分子中只有4种不同化学环境的氢。
Ⅲ. 能与NaHCO3反应生成CO2。
(5)根据已有知识并结合相关信息,写出以![]() 和乙酸酐为原料制备
和乙酸酐为原料制备![]() 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:H2C=CH2
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH__________
CH3CH2OH__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.常温常压下,11.2L二氧化碳含有的原子数等于1.5NA
B.标准状况下,22.4LCCl4中所含分子数为NA
C.标准状况下,18g水所含原子数为NA
D.常温常压下,48gO2与O3混合物含有的氧原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
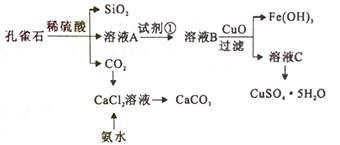
下列说法正确的是
A. 为将溶液A中的Fe2+氧化为Fe3+,试剂①可选用双氧水、氯气等
B. 流程中所加的CuO可以用Cu代替
C. 由溶液C获得CuSO4·5H2O,需要经过蒸发浓缩、冷却结晶、过滤、洗涤等操作
D. 制备CaCO3时,应向CaCl2溶液中先通入CO2,再加入氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
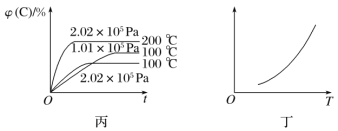
【题目】如图所示,甲、乙、丙分别表示在不同条件下可逆反应A(g)+B(g)![]() xC(g)的生成物C在反应混合物中的体积分数和反应时间的关系。
xC(g)的生成物C在反应混合物中的体积分数和反应时间的关系。
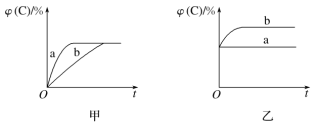
(1)若甲图中两条曲线分别代表有催化剂和无催化剂的情况,则________曲线表示无催化剂时的情况,反应速率:a________(填“大于”“小于”或“等于”)b。
(2)若乙图表示反应达到平衡后,分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入氦气后的情况,则________曲线表示恒温恒容的情况,在恒温恒容条件下,C的体积分数________(填“变大”“变小”或“不变”)。
(3)根据丙图可以判断该可逆反应的正反应是________(填“放热”或“吸热”)反应,化学计量数x的取值范围是______________。
(4)丁图表示在某固定容积的密闭容器中,上述可逆反应达到平衡后,某物理量随着温度(T)的变化情况。根据你的理解,丁图的纵轴可以是________________(填序号)。①φ(C)/%、②A的转化率、③B的转化率、④压强、⑤c(A)、⑥c(B);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质中,一定是同系物的是( )
A. C3H8和2-甲基1-丁烯
B. 3-甲基-1-丁炔和3-甲基-1-戊炔
C. ![]() 和
和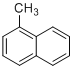
D. C4H10和C9H18
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某浓度的氨水中存在下列平衡:NH3·H2O ![]() NH4++OH-,若想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
NH4++OH-,若想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
A. 适当升高温度B. 加入NaCl固体C. 通入NH3D. 加入少量盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用图甲装置制备了氯气,并进行了一系列实验。
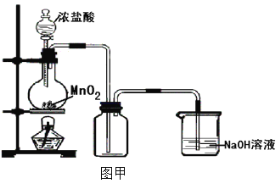
(1)实验室制备氯气的反应原理是_______________________
(2)若有87gMnO2参加反应,则被氧化的氯化氢的物质的量为____________;而实际收集的氯气量准是比理论值小,试写出其可能的一种原因____________
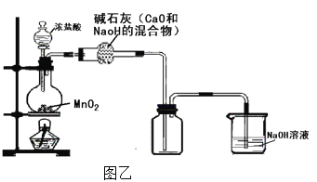
(3)乙同学认为图甲装置制备的氯气不纯净,其中混有HCl气体和水蒸气,对装置进行了如图乙改进。你认为合理吗?____________ (合理则填入“合理”二字,如不合理则用文字说明理由)
(4)将图甲装置合理改装后制取并收集一瓶氯气,将灼热的铁丝插到充满氯气的集气瓶中,看到铁丝在氯气中继续燃烧,在集气瓶内充满棕色的烟,烟的成分为反应方程式为____________
(5)另收集一瓶氯气并在集气瓶中加入水,观察到液体为浅黄绿色,有此现象的原因是____________;将溶液分成三份,分别加入一-定量的下列溶液,写出反应的方程式:
Na2CO3溶液____________
AgNO3溶液____________
KI溶液____________
(6)若实验中有少量的氯气散发到空气中,试设计方案将其检测出____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com