
【题目】某浓度的氨水中存在下列平衡:NH3·H2O ![]() NH4++OH-,若想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
NH4++OH-,若想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
A. 适当升高温度B. 加入NaCl固体C. 通入NH3D. 加入少量盐酸
 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案 互动课堂系列答案
互动课堂系列答案科目:高中化学 来源: 题型:
【题目】某同学采用工业大理石(含有少量SiO2、Al2O3、Fe2O3等杂质)制取CaCl2·6H2O,设计了如下流程:
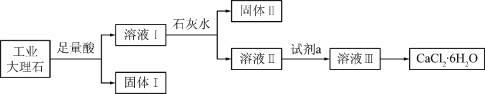
下列说法不正确的是
A. 固体I中含有SiO2,固体II中含有Fe(OH)3
B. 使用石灰水时,要控制pH,防止固体II中Al(OH)3转化为AlO2-
C. 试剂a选用盐酸,从溶液III得到CaCl2·6H2O产品的过程中,须控制条件防止其分解
D. 若改变实验方案,在溶液I中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也可得到纯净CaCl2·6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
(1)配平以下方程式
__K2Cr2O7+__HC1=__KC1+__CrCl3+__H2O+__Cl2↑
(2)以上反应中失电子的物质是__,还原产物是__,每生成lmol这种还原产物,将有__mol电子发生转移。氧化剂与还原剂的物质的量之比为___。
(3)已知反应:2H2S+H2SO3=2H2O+3S↓,若氧化产物比还原产物多1.6g,则同时会生成水的质量为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数
(1)一杯咖啡中含有0.194g咖啡因(分子式C8H10N4O2),你知道其中有___个咖啡因分子;这些咖啡因分子中的N原子的物质的量为__。
(2)若某单原子气体,一个该原子的真实质量为ag,则其摩尔质量是___,其标况下的密度是__g·L-1。
(3)0.2mol H2S中含___个电子;等物质的量的CH4和H2S中氢原子个数比是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各题
(1)写出硫酸氢钠在水溶液中的电离方程式___;
(2)写出下列反应的离子方程式:
①氧化镁加入稀硫酸中___;
②氨水中加入稀盐酸___;
③FeCl3溶液中加入NaOH溶液:___。
(3)在标准状况下,4.48L的NH3气体物质的量为___mol,质量为___g,其中含___个氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷及其化合物在科研及生产中均有着重要的应用.
(1)室温下,0.1mol/L的亚硝酸(HNO2)、次氯酸的电离常数分Ka别为:7.1×10-4、2.98×10-8.写出HNO2、HClO、NaNO2、NaClO四种物质之间发生的复分解反应的离子方程式________。
(2)羟胺(NH2OH)可看成是氨分子内的1个氢原子被羟基取代的产物,常用作还原剂,其水溶液显弱碱性。已知NH2OH在水溶液中呈弱碱性的原理与NH3在水溶液中相似,请用电离方程式表示其原因________________。
(3)亚硝酸钠与氯化钠都是白色粉末,且都有咸味,但亚硝酸盐都有毒性,通常它们可以通过加入热的白醋鉴别,亚硝酸钠遇到白醋会产生一种红棕色刺激性气味气体和一种无色气体,其中的无色气体遇到空气会呈红棕色,该反应的离子方程式为_________。
(4)某液氨一液氧燃料电池示意图如下,该燃料电池的工作效率为50%,现用作电源电解500ml的饱和NaCl溶液,电解结束后,所得溶液中NaOH的浓度为0.3mol/L,则该过程中消耗氨气的质量为________(假设溶液电解前后体积不变)。
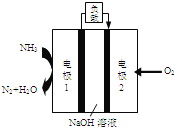
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设nA为阿伏伽德罗常数的数值,下列说法正确的是
A. 23g Na 与足量H2O反应完全后可生成nA个H2分子
B. 1 molCu和足量热浓硫酸反应可生成nA个SO3分子
C. 标准状况下,22.4L N2和H2混合气中含nA个原子
D. 3mol单质Fe完全转变为Fe3O4,失去8nA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示装置(部分仪器已略去)回答下列有关问题。
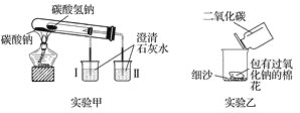
(1)实验甲在加热过程中能观察到产生白色沉淀的烧杯是________(填“Ⅰ”或“Ⅱ”),该烧杯中发生反应的离子方程式是________,通过实验甲可证明______(填“Na2CO3”或“NaHCO3”)更稳定。
(2)实验乙用来探究Na2O2与CO2的反应,观察到的实验现象为包有Na2O2的棉花着火。写出Na2O2与CO2反应的化学方程式:_________,棉花着火说明该反应的特点是_________
(3)取10 g碳酸钠和碳酸氢钠的混合物充分加热,将生成的CO2气体通入足量的澄清石灰水中,测得生成沉淀的质量为4.0 g。则原混合物中碳酸钠的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组欲配制245mL 0.1mol/L硫酸亚铁溶液,实验室有如下两种试剂:①FeSO4·7H2O,②5mol/LFeSO4溶液,现分两小组分别进行实验,第一小组选择试剂①,第二小组选择试剂②。
(1)第一小组称量试剂①的质量为__________g。
(2)第二小组经计算需要______mL5mol/LFeSO4溶液,在量取试剂②后,进行了下列操作:
a.等稀释的溶液的温度与室温一致后,沿玻璃棒注入容量瓶中。
b. ________使溶液的液面与瓶颈的刻度标线相切。
c.在盛FeSO4溶液的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
d.用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)____________。若量取的是浓硫酸,简述第c步实验的具体操作步骤:________
(3)在上述配制过程中,若出现以下情况,对溶液浓度有何影响?
A 用量筒量取试剂②时仰视观察凹液面。
B 稀释的FeSO4溶液未恢复至室温,沿玻璃棒注入容量瓶中。
C 未用蒸馏水洗涤烧杯和玻璃棒。
D 定容时,仰视观察凹液面。
E 定容后把容量瓶倒置摇匀,发现液面低于刻度线,又加水至刻度线。
F 配制溶液时,容量瓶中有蒸馏水。
偏高:______________ 偏低:____________ 无影响:_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com