
【题目】氮、磷及其化合物在科研及生产中均有着重要的应用.
(1)室温下,0.1mol/L的亚硝酸(HNO2)、次氯酸的电离常数分Ka别为:7.1×10-4、2.98×10-8.写出HNO2、HClO、NaNO2、NaClO四种物质之间发生的复分解反应的离子方程式________。
(2)羟胺(NH2OH)可看成是氨分子内的1个氢原子被羟基取代的产物,常用作还原剂,其水溶液显弱碱性。已知NH2OH在水溶液中呈弱碱性的原理与NH3在水溶液中相似,请用电离方程式表示其原因________________。
(3)亚硝酸钠与氯化钠都是白色粉末,且都有咸味,但亚硝酸盐都有毒性,通常它们可以通过加入热的白醋鉴别,亚硝酸钠遇到白醋会产生一种红棕色刺激性气味气体和一种无色气体,其中的无色气体遇到空气会呈红棕色,该反应的离子方程式为_________。
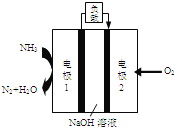
(4)某液氨一液氧燃料电池示意图如下,该燃料电池的工作效率为50%,现用作电源电解500ml的饱和NaCl溶液,电解结束后,所得溶液中NaOH的浓度为0.3mol/L,则该过程中消耗氨气的质量为________(假设溶液电解前后体积不变)。
【答案】HNO2+ClO- =NO2-+HClO NH2OH+H2O![]() NH3OH++OH- 2NO2-+2CH3COOH=NO2+NO+2CH3COO-+ H2O 1.7g
NH3OH++OH- 2NO2-+2CH3COOH=NO2+NO+2CH3COO-+ H2O 1.7g
【解析】
(1)亚硝酸属于弱酸,其水溶液加水稀释,促进亚硝酸的电离,但溶液体积增大,c(H+)减小;同种物质的电离平衡常数只与温度有关,温度不变,![]() 值不变;根据亚硝酸和次氯酸的电离常数
值不变;根据亚硝酸和次氯酸的电离常数![]() 可知:亚硝酸酸性强于次氯酸,根据强酸制弱酸可知离子方程式为:HNO2+ClO- =NO2-+HClO 。
可知:亚硝酸酸性强于次氯酸,根据强酸制弱酸可知离子方程式为:HNO2+ClO- =NO2-+HClO 。
(2)NH3在水溶液中显碱性是因为氨分子结合水中的氢,电离出氢氧根,使得溶液显碱性,所以NH2OH在水溶液中呈弱碱性,是因为NH2OH分子结合水中的氢,电离出氢氧根,用电离方程式表示为NH2OH+H2O![]() NH3OH++OH-。
NH3OH++OH-。
(3)红棕色刺激性气味气体为NO2,根据化合价升降守恒可知另一刺激性气体为NO,醋酸是弱酸,所以离子方程式为2NO2-+2CH3COOH=NO2+NO+2CH3COO-+ H2O。
(4)根据电池示意图可知电极1发生的电极反应式为![]() 。电解NaCl溶液的方程式为:
。电解NaCl溶液的方程式为:![]() ,溶液中NaOH的浓度为
,溶液中NaOH的浓度为![]() ,溶液体积为0.5L,则生成的n(NaOH)=0.15mol,转移电子的物质的量为0.15mol,因为燃料电池的工作效率为50%,则燃料电池中转移电子的物质的量为
,溶液体积为0.5L,则生成的n(NaOH)=0.15mol,转移电子的物质的量为0.15mol,因为燃料电池的工作效率为50%,则燃料电池中转移电子的物质的量为![]() ,根据氨气侧的电极反应式可知消耗氨气的物质的量为0.1mol,质量为1.7g。
,根据氨气侧的电极反应式可知消耗氨气的物质的量为0.1mol,质量为1.7g。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】对于易燃、易爆、有毒的 化学物质,往往会在其包装上贴上危险警告标签.下面所 列的物质中,标签贴错了的是
选项 | A | B | C | D |
物质的化学式 | 氢氧化钠 | 金属汞 | 四氯化碳 | 烟花爆竹 |
危险警告标签 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
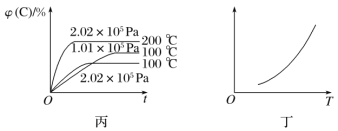
【题目】如图所示,甲、乙、丙分别表示在不同条件下可逆反应A(g)+B(g)![]() xC(g)的生成物C在反应混合物中的体积分数和反应时间的关系。
xC(g)的生成物C在反应混合物中的体积分数和反应时间的关系。
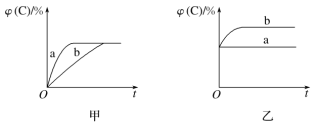
(1)若甲图中两条曲线分别代表有催化剂和无催化剂的情况,则________曲线表示无催化剂时的情况,反应速率:a________(填“大于”“小于”或“等于”)b。
(2)若乙图表示反应达到平衡后,分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入氦气后的情况,则________曲线表示恒温恒容的情况,在恒温恒容条件下,C的体积分数________(填“变大”“变小”或“不变”)。
(3)根据丙图可以判断该可逆反应的正反应是________(填“放热”或“吸热”)反应,化学计量数x的取值范围是______________。
(4)丁图表示在某固定容积的密闭容器中,上述可逆反应达到平衡后,某物理量随着温度(T)的变化情况。根据你的理解,丁图的纵轴可以是________________(填序号)。①φ(C)/%、②A的转化率、③B的转化率、④压强、⑤c(A)、⑥c(B);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按系统命名法填写下列有机物的名称及有关内容。
![]()
(1)如图化合物分子式为:___________________,1mol该物质完全燃烧消耗____________mol O2
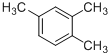
(2)如图化合物名称:___________________
(3)2-甲基-3-戊炔结构简式: _________________
(4)分子式为C4H8的三种烯烃的结构简式及名称.
① __________________________________________________
② _________________________________________________
③ __________________________________________________
(5)写出下列化合物中含有的官能团及其对应的名称
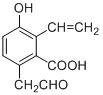
_________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某浓度的氨水中存在下列平衡:NH3·H2O ![]() NH4++OH-,若想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
NH4++OH-,若想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
A. 适当升高温度B. 加入NaCl固体C. 通入NH3D. 加入少量盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用NaOH固体配制240mL 1.00mol/L的NaOH溶液,回答下列问题:
(1)配制1.00mol/L的NaOH溶液,应称取NaOH的质量_______g,需要的仪器为:量筒、烧杯,玻璃棒、托盘天平、砝码、______ 、______。
(2)容量瓶上需标有以下五项中的_____________________;
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)______。
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需的NaOH的质量,加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
F.用胶头滴管加水至溶液凹液面与刻度线相切
(4)下列配制的溶液浓度偏低的是____________
A.称量NaOH时,将NaOH放在纸上称重
B.配制前,容量瓶中有少量蒸馏水
C.配制时,NaOH未冷却直接定容
D.加蒸馏水时不慎超过了刻度线
E.定容时俯视刻度线
F.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸分别加水稀释至平衡,pH随溶液体积变化的曲线如下图所 示。据图判断正确的是

A. Ⅱ为盐酸稀释时的pH变化曲线
B. b点溶液的导电性比c点溶液的导电性强
C. a点KW的数值比c点KW的数值大
D. b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl- 。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:

已知:3NO3-+ 8Al + 5OH- + 2H2O![]() 3NH3 + 8AlO2-
3NH3 + 8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是
试样中肯定存在NH4+、Mg2+、SO42-和NO3-
试样中一定不含Al3+
试样中可能存在Na+、Cl-
该雾霾中可能存在NaNO3 、NH4Cl和MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁(FeC2O4)常用作分析剂、显影剂以及新型电池材料磷酸亚铁锂的生产。某草酸亚铁样品(不含结晶水)中含有少量草酸,现用滴定法测定该样品中FeC2O4的含量。实验方案如下:
①将0.20 g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol·L-1的H2SO4溶液,使样品溶解,加热至70 ℃左右,立即用高锰酸钾溶液滴定至终点。
②向滴定终点混合液中加入适量的Zn粉和过量的2 mol·L-1的H2SO4溶液,煮沸5~8 min。用KSCN溶液在点滴板上检验煮沸液,直至溶液不变红,将其过滤至另一个锥形瓶中,用0.020 00 mol·L-1的高锰酸钾标准溶液滴定该溶液至终点,消耗高锰酸钾标准液6.00 mL。
试回答下列问题:
(1)高锰酸钾标准液用________滴定管盛装(填“酸式”或“碱式”)。
(2)在步骤①中,滴加高锰酸钾溶液时观察到有无色气体产生,则高锰酸钾与草酸反应的离子方程式为______________________________________________________。
(3)滴定过程中眼睛应注视__________________ ,滴定终点现象是 ___________________
(4)在步骤②中,下列操作会引起测定结果偏高的是_____________。
a 滴定管在盛装高锰酸钾前未润洗
b 滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
c 滴定前读数正确,滴定终点时俯视读数
d 滴定前尖嘴有气泡,滴定后气泡消失
(5)0.20 g样品中FeC2O4的质量分数为____。(保留3位有效数字,不考虑步骤②中的损耗)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com