
【题目】如图所示,甲、乙、丙分别表示在不同条件下可逆反应A(g)+B(g)![]() xC(g)的生成物C在反应混合物中的体积分数和反应时间的关系。
xC(g)的生成物C在反应混合物中的体积分数和反应时间的关系。
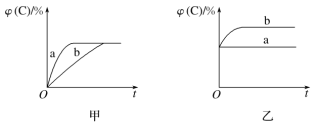
(1)若甲图中两条曲线分别代表有催化剂和无催化剂的情况,则________曲线表示无催化剂时的情况,反应速率:a________(填“大于”“小于”或“等于”)b。
(2)若乙图表示反应达到平衡后,分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入氦气后的情况,则________曲线表示恒温恒容的情况,在恒温恒容条件下,C的体积分数________(填“变大”“变小”或“不变”)。
(3)根据丙图可以判断该可逆反应的正反应是________(填“放热”或“吸热”)反应,化学计量数x的取值范围是______________。
(4)丁图表示在某固定容积的密闭容器中,上述可逆反应达到平衡后,某物理量随着温度(T)的变化情况。根据你的理解,丁图的纵轴可以是________________(填序号)。①φ(C)/%、②A的转化率、③B的转化率、④压强、⑤c(A)、⑥c(B);
【答案】b 大于 a 不变 吸热 x>2 ①②③④
【解析】
(1)催化剂可加快化学反应速率,缩短反应达到平衡的时间,据此作答;
(2)结合图像并依据恒温恒容条件下各物质的浓度保持不变分析;
(3)依据温度和压强对化学平衡的影响作答;
(4)结合图像依据外因对平衡移动的影响因素作答。
(1)使用催化剂,加快反应速率,缩短到达平衡的时间,由图可知,a先到达平衡,故b曲线表示无催化剂的情况,b曲线表示没有使用催化剂,反应速率:a大于b,
故答案为:b;大于;
(2)恒温恒容条件下,通入惰性气体,不影响反应混合气体各组分的浓度,平衡不移动,则a曲线表示恒温恒容的情况,在恒温恒容条件下,C的体积分数不变,
故答案为:a;不变;
(3)由丙图可知,相同压强温度越高,φ(C)越大,说明升高温度,平衡向正反应移动,正反应为吸热反应,温度相同压强越高,φ(C)越小,说明增大压强,平衡向逆反应移动,故x>1+1,即x>2,
故答案为:吸热;x>2;
(4) 该反应正反应为吸热反应,反应前后气体的体积增大,升高温度,平衡向吸热方向移动,即向右移动;由图可知,纵轴所表示的量随温度升高而增大,升高温度,平衡向吸热方向移动,即向右移动,C的含量增大,A、B的转化率增大,平衡时A、B浓度降低。反应前后气体的体积增大,在恒容条件下,升高温度,平衡向吸热方向移动,即向右移动,混合物总的物质的量增加,所以平衡时,容器内压强增大。故①②③④符合,
故答案为:①②③④;


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】根据有机化学基础,请回答下列问题:
(1)如图是含C、H、O三种元素的某有机分子模型(图中球与球之间的连线代表单键、双键等化学键),其所含官能团的名称为_______________________

(2)![]() 的名称(系统命名)________
的名称(系统命名)________![]() 的分子式为 _________
的分子式为 _________
(3)分子式为C5H10,且属于烯的同分异构体有_______种(不考虑立体异构)
(4)某有机化合物A经李比希法测得其中含碳为72.0%、含氢为6.67%,其余为氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
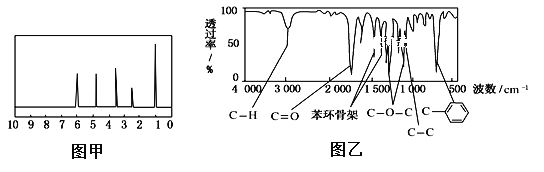
方法一:用质谱法分析得知A的相对分子质量为150。
方法二:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1:2:2:2:3,如图甲所示。
方法三:利用红外光谱仪测得A分子的红外光谱如图乙所示。
则A的分子式为________,写出符合条件的A的一种结构简式____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用粗制ZnO粉末(含杂质Fe、Ni等)制备高纯ZnO的流程如下:
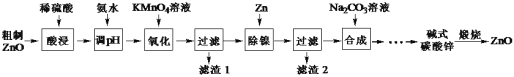
已知:本实验条件下,Ni2+不能被氧化,高锰酸钾还原产物为MnO2
(1)加快酸浸速率可采取的措施______。(任举一条)
(2)调pH约为5,再加KMnO4溶液进行氧化。写出“氧化”步骤对应的离子方程式______。
(3)“滤渣2”的成分是______。
(4)流程中“![]() ”涉及的操作有______、洗涤、______。
”涉及的操作有______、洗涤、______。
(5)获得的碱式碳酸锌需要用水洗涤,检验沉淀是否洗涤干净的方法是_____。
(6)已知Ksp[Fe(OH)3]=2.6×10-39。 25℃时,调节某酸性废水的pH值,使溶液中的Fe3+残留浓度为2.6×10-6molL-1,则pH应调至______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅酸钠被国家列为“我国优先发展的精细化学品”和“今后我国无机化工产品发展重点”之一。下图是用海边的石英砂(含氯化钠、氧化铁等杂质)制备硅酸钠的工艺流程示意简图:

(1)要将洗出液中的溶质析出,采用的方法是_________。
A.蒸发结晶 B.冷却结晶
C.先蒸发,再冷却结晶 D.先冷却,再蒸发结晶
(2)在以上流程中,要将洗净的石英砂研磨成粉末,目的是_____________________________。
(3)蒸发时用到的硅酸盐仪器有____________________________________________________。
(4)上述流程中加入NaOH溶液,反应的离子方程式是_______________________________。
(5)硅酸钠溶液呈____性,硅酸钠的用途很广,其中的一种用途是_______________________。
(6)将用上流程中的残渣来焊接铁轨,反应的化学方程式是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
(1)配平以下方程式
__K2Cr2O7+__HC1=__KC1+__CrCl3+__H2O+__Cl2↑
(2)以上反应中失电子的物质是__,还原产物是__,每生成lmol这种还原产物,将有__mol电子发生转移。氧化剂与还原剂的物质的量之比为___。
(3)已知反应:2H2S+H2SO3=2H2O+3S↓,若氧化产物比还原产物多1.6g,则同时会生成水的质量为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同分异构现象在有机化学中是非常普遍的,下列有机化合物不是同分异构体的一组是( )
①CH2=CHCH3②![]() ③CH3CH2CH3④CH3CH2CH=CH2⑤
③CH3CH2CH3④CH3CH2CH=CH2⑤![]() ⑥CH3CH=CHCH3
⑥CH3CH=CHCH3
A. ①和②
B. ①和③
C. ④和⑥
D. ⑤和⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数
(1)一杯咖啡中含有0.194g咖啡因(分子式C8H10N4O2),你知道其中有___个咖啡因分子;这些咖啡因分子中的N原子的物质的量为__。
(2)若某单原子气体,一个该原子的真实质量为ag,则其摩尔质量是___,其标况下的密度是__g·L-1。
(3)0.2mol H2S中含___个电子;等物质的量的CH4和H2S中氢原子个数比是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
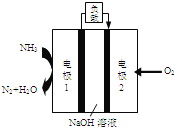
【题目】氮、磷及其化合物在科研及生产中均有着重要的应用.
(1)室温下,0.1mol/L的亚硝酸(HNO2)、次氯酸的电离常数分Ka别为:7.1×10-4、2.98×10-8.写出HNO2、HClO、NaNO2、NaClO四种物质之间发生的复分解反应的离子方程式________。
(2)羟胺(NH2OH)可看成是氨分子内的1个氢原子被羟基取代的产物,常用作还原剂,其水溶液显弱碱性。已知NH2OH在水溶液中呈弱碱性的原理与NH3在水溶液中相似,请用电离方程式表示其原因________________。
(3)亚硝酸钠与氯化钠都是白色粉末,且都有咸味,但亚硝酸盐都有毒性,通常它们可以通过加入热的白醋鉴别,亚硝酸钠遇到白醋会产生一种红棕色刺激性气味气体和一种无色气体,其中的无色气体遇到空气会呈红棕色,该反应的离子方程式为_________。
(4)某液氨一液氧燃料电池示意图如下,该燃料电池的工作效率为50%,现用作电源电解500ml的饱和NaCl溶液,电解结束后,所得溶液中NaOH的浓度为0.3mol/L,则该过程中消耗氨气的质量为________(假设溶液电解前后体积不变)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com