
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.常温常压下,11.2L二氧化碳含有的原子数等于1.5NA
B.标准状况下,22.4LCCl4中所含分子数为NA
C.标准状况下,18g水所含原子数为NA
D.常温常压下,48gO2与O3混合物含有的氧原子数为3NA
科目:高中化学 来源: 题型:
【题目】(1)0.5molCH4含______个电子。
(2)下列物质既能导电,又属于电解质的是_______ 。
A NaCl溶液 B 铁丝 C 稀硫酸 D 熔融的氢氧化钠 E 盐酸 F 硫酸
(3)同温同压下,甲容器中HCl气体和乙容器中的NH3所含原子个数相等,则甲乙两容器的体积之比为________。
(4)现配制500ml 0.3mol/L稀硫酸溶液,需用量筒量取质量分数为49%,密度为1.5g/cm3的浓硫酸 _________ml。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用工业大理石(含有少量SiO2、Al2O3、Fe2O3等杂质)制取CaCl2·6H2O,设计了如下流程:
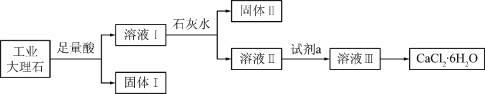
下列说法不正确的是
A. 固体I中含有SiO2,固体II中含有Fe(OH)3
B. 使用石灰水时,要控制pH,防止固体II中Al(OH)3转化为AlO2-
C. 试剂a选用盐酸,从溶液III得到CaCl2·6H2O产品的过程中,须控制条件防止其分解
D. 若改变实验方案,在溶液I中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也可得到纯净CaCl2·6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用粗制ZnO粉末(含杂质Fe、Ni等)制备高纯ZnO的流程如下:
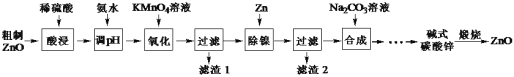
已知:本实验条件下,Ni2+不能被氧化,高锰酸钾还原产物为MnO2
(1)加快酸浸速率可采取的措施______。(任举一条)
(2)调pH约为5,再加KMnO4溶液进行氧化。写出“氧化”步骤对应的离子方程式______。
(3)“滤渣2”的成分是______。
(4)流程中“![]() ”涉及的操作有______、洗涤、______。
”涉及的操作有______、洗涤、______。
(5)获得的碱式碳酸锌需要用水洗涤,检验沉淀是否洗涤干净的方法是_____。
(6)已知Ksp[Fe(OH)3]=2.6×10-39。 25℃时,调节某酸性废水的pH值,使溶液中的Fe3+残留浓度为2.6×10-6molL-1,则pH应调至______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O氧化剂是______,氧化产物与还原产物的物质的量之比为_______。
(2)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3∶2, 完成下列化学方程式(横线上填系数,括号内填物质):① ___KMnO4+____K2S+______===___K2MnO4+___K2SO4+___S↓+______。
② 若生成6.4g单质硫,反应过程中转移电子的物质的量为___。
(3)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染,化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气),若反应中消耗Cl2 1.5mol则被氧化的NH3在标准状况下的体积为____ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅酸钠被国家列为“我国优先发展的精细化学品”和“今后我国无机化工产品发展重点”之一。下图是用海边的石英砂(含氯化钠、氧化铁等杂质)制备硅酸钠的工艺流程示意简图:

(1)要将洗出液中的溶质析出,采用的方法是_________。
A.蒸发结晶 B.冷却结晶
C.先蒸发,再冷却结晶 D.先冷却,再蒸发结晶
(2)在以上流程中,要将洗净的石英砂研磨成粉末,目的是_____________________________。
(3)蒸发时用到的硅酸盐仪器有____________________________________________________。
(4)上述流程中加入NaOH溶液,反应的离子方程式是_______________________________。
(5)硅酸钠溶液呈____性,硅酸钠的用途很广,其中的一种用途是_______________________。
(6)将用上流程中的残渣来焊接铁轨,反应的化学方程式是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
(1)配平以下方程式
__K2Cr2O7+__HC1=__KC1+__CrCl3+__H2O+__Cl2↑
(2)以上反应中失电子的物质是__,还原产物是__,每生成lmol这种还原产物,将有__mol电子发生转移。氧化剂与还原剂的物质的量之比为___。
(3)已知反应:2H2S+H2SO3=2H2O+3S↓,若氧化产物比还原产物多1.6g,则同时会生成水的质量为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数
(1)一杯咖啡中含有0.194g咖啡因(分子式C8H10N4O2),你知道其中有___个咖啡因分子;这些咖啡因分子中的N原子的物质的量为__。
(2)若某单原子气体,一个该原子的真实质量为ag,则其摩尔质量是___,其标况下的密度是__g·L-1。
(3)0.2mol H2S中含___个电子;等物质的量的CH4和H2S中氢原子个数比是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示装置(部分仪器已略去)回答下列有关问题。
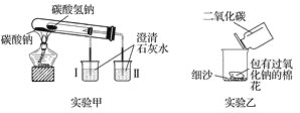
(1)实验甲在加热过程中能观察到产生白色沉淀的烧杯是________(填“Ⅰ”或“Ⅱ”),该烧杯中发生反应的离子方程式是________,通过实验甲可证明______(填“Na2CO3”或“NaHCO3”)更稳定。
(2)实验乙用来探究Na2O2与CO2的反应,观察到的实验现象为包有Na2O2的棉花着火。写出Na2O2与CO2反应的化学方程式:_________,棉花着火说明该反应的特点是_________
(3)取10 g碳酸钠和碳酸氢钠的混合物充分加热,将生成的CO2气体通入足量的澄清石灰水中,测得生成沉淀的质量为4.0 g。则原混合物中碳酸钠的质量分数为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com