
【题目】今年6月20日,2016年全球最受关注的十大化学成果发布,其中有两项与空气中的二氧化碳处理利用技术有关。其一为美国伊利诺斯大学芝加哥分校和阿贡国家实验室科学家联合设计的新型太阳能电池,可直接把大气中的二氧化碳转化为合成气(CO和H2)该设计同时具有环保和经济价值,不仅可以减缓二氧化碳的排放,而且可以生成重要的化工原料。
(1)下列材料也可以用于制造太阳能电池的是____________。
A.Ag2O B.Fe3O4 C.Si D.SiO2
(2)下图装置可实现二氧化碳到一氧化碳的转化

①电源的正极为______(“A”或“B")。
②阴极发生反应的电极方程式为:___________.
(3)CO 和H2可用于合成甲醇。
①已知CO、H2、CH3OH(1)的燃烧热为283.0kJ/mol、285. 8kJ/mol、726.5kJ/mol,写出 由CO和H2制备CH3OH(1)的热化学方程式__________。
②在398K,1L的恒容容器中充入0.1molCO和0.2molH2,发生反应CO(g)+2H2(g)=CH3OH(g),反应过程中气体的压强如下表所示(atm为标准大气压)。
时间(min) | 0 | 1 | 5 | 10 | 30 | 50 |
压强(atm) | 10 | 9.3 | 8.0 | 7.2 | 4 | 4 |
5min内该反应的平均速率用CO可表示为______,该温度下的平衡常数是_____。达到平衡后,向该容器中通入0.05mol的气态CH3OH,再次达到平衡时,CH3OH的体积分数比原平衡时_____( 填“大”或“小”)。
【答案】 C B CO2+ H2O+2e-=CO+2OH- CO(g)+2H2(g)=CH3OH(l) △H=-128.1kJ·mol-1 0.006mol·L-1·min-1 2.25×104 大
【解析】(1)本题考查材料,制造太阳能电池的材料是晶体硅,故选项C正确;(2)本题考查电解原理和电极反应式的书写,①根据题中信息,CO2转化成CO,化合价降低,根据电解原理,左端碳棒为阴极,即电源的A为负极,B为正极;②根据装置图,CO2→CO,电极反应式为 CO2+H2O+2e-=CO+2OH-;(3)本题考查热化学反应方程式的计算、化学反应速率的计算、化学平衡的计算,①CO(g)+1/2O2(g) =CO2(g) △H=-283.0kJ·mol-1①,H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ·mol-1②,CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-726.5kJ·mol-1③,①+2×②-③的得出:CO(g)+2H2(g)=CH3OH(l) △H=-128.1kJ·mol-1;②CO(g) + 2H2(g) = CH3OH(g)
起始:0.1 0.2 0
变化:x 2x x
平衡:0.1-x 0.2-2x x 温度相同,体积相同,压强之比等于物质的量之比,因此有0.3/(0.3-2x)=10/8,解得x=0.03mol,根据化学反应速率的表达式,v(CO)=0.03/(5×1)mol/(L·min)=0.006 mol/(L·min),同理,0.3/(0.3-2x)=10/4,解得x=0.09,则达到平衡时n(CO)=0.01mol,n(H2)=0.02mol,n(CH3OH)=0.09,体积为1L,根据化学平衡常数的表达式,则K=0.09/(0.01×0.022)= 2.25×104,再通入0.05molCH3OH,相当于在原来基础增大压强,则甲醇的体积分数比原平衡时大。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】下列各离子方程式中,属于水解反应的是( )
A.HCO3﹣+H2OH3O++CO32﹣
B.NH4++H2ONH3H2O+OH﹣
C.PO43﹣+H2OHPO42﹣+OH﹣
D.H2O+H2OH3O++OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示的一些物质或概念间的从属关系中正确的是

X | Y | Z | |
A | 二氧化氮 | 酸性氧化物 | 氧化物 |
B | 硫酸 | 化合物 | 电解质 |
C | 胶体 | 分散系 | 混合物 |
D | 置换反应 | 氧化还原反应 | 离子反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学实验探究氨气的还原性并进行系列实验.
(1)将光亮的紫红色铜丝绕几圈后,在酒精灯火焰上加热,等铜丝变黑后,趁热将铜丝插入疏松的氯化铵晶体里,即刻发现有白色烟雾生成,拿出铜丝后,铜丝又转变为光亮的紫红色.在焊接铜器时用氯化铵除去铜器表面的氧化铜即利用了该原理,请完成该反应: CuO+NH4Cl=Cu+CuCl2+N2↑+
(2)利用下列装置,进行与金属氧化物MxOy反应生成M、H2、H2O,通过测量生成水的质量来测定M的相对原子质量.a中试剂是浓氨水. 
①仪器a的名称为 , 仪器b中装入的试剂可以是 .
②按气流方向正确的装置连接(填序号,装置可重复使用): .
③实验结束时,应首先(填序号).
I.熄灭A装置的酒精灯
II.停止从a中滴加液体
④若实验中准确称取金属氧化物的质量为mg,完全反应后,测得生成水的质量为ng,则M的相对原子质量为(用x、y、m、n的式子表示).
(3)若金属氧化物MxOy为Fe2O3 , 将反应后固体溶于稀硫酸,然后滴加KSCN溶于没发现明显变化.推测该固体成分可能是(将化学式填入下表,你认为有几种可能填几种).
序号 | 固体成分(填化学式) |
1 | |
2 | |
3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应N2O4(g)![]() 2NO2(g)在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点)
2NO2(g)在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点)
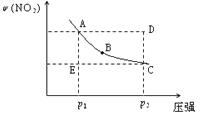
(1)B、C两点的反应速率的关系为B_________C(填“>”“<”或“=”)。
(2)当反应处于A状态时,V正_____V逆(填“>”“<”或“=”),A、B、C、D、E各状态中,V正<V逆的是_______________________。
(3)由D状态转变为C状态后,混合气体的总物质的量会______(填“增大”、“减小”)。
(4)若在注射器中盛有一定量NO2,向内推活塞至原有体积的3/4,达到平衡时其中气体颜色较初始颜色如何变化_______,其原理为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米铜有很多奇特的性质,比如超塑延展性,在室温下可拉长50多倍而不出现裂纹,铜纳米晶体的这种机械特性为制造常温下的弹性物质开辟了光明前景。此外,纳米铜还用作热氨发生器、凝胶推进剂、燃烧活性剂、催化剂、水清洁吸附剂、烧结活性剂等。纳米铜比普通铜更容易与氧气发生反应,常温下在空气中可以自燃。以下是纳米铜的一种制备工艺,用于制备50~100nm的铜粉。

已知:油酸(C17H33COOH)难溶于水,可溶于乙醇。
步骤①中发生的反应为:2C17H33COOH +Cu2+![]() Cu(C17H33COO)2 +2H+
Cu(C17H33COO)2 +2H+
步骤②中发生的反应为:2Cu(C17H33COO)2 + C6H12O6+5OH- =Cu2O+C5H11COO-+4C17H33COO-
回答下列问题:
(1)将纳米铜粉加人燕馏水中,搅拌均匀后,得到的分散系类型是_________
(2)步骤①中调节pH5.5~6.0时,萃取率最高,pH不能过大也不能过小,若过小则______,若过大则__。
(3)NaH2PO2中P的化合价是_______,在步骤③中被氧化得到的产物是NaH2PO3,该反应的化学方程式是_____。已知NaH2PO2为正盐且溶液呈碱性.NaH2PO2溶液呈碱性原因用离子方程式可表示为_。
(4)用乙醇清洗产物的目的是__________。
(5)真空干燥产品的原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、铁的混合物溶于足量的盐酸中,再加入过量的NaOH溶液,在空气中静置,当红褐色沉淀不再增加,将沉淀滤出并充分灼烧,得到的固体残留物恰好跟原混合物的质量相等,则此合金中铝的质量分数为( )
A.22.2%
B.30.0%
C.75.7%
D.80.6%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列条件一定能使反应速率加快的是( )
①增加反应物的物质的量
②升高温度
③缩小反应容器的体积
④加入生成物
⑤加入MnO2 .
A.全部
B.①②⑤
C.②
D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com