
����Ŀ��ij��ѧ��ȤС��ͬѧ�������������������Բ��˲�����֮˵������Ȥ�����ʵ��������̽�����������ױ����������е���Ԫ���Բ�����������ʽ���ڣ�����������һ�ֵ���ɫ������ˮ�ľ��塣
I.��������Ԫ�غ����IJⶨ
(1)ȡ100gϴ�����ɵ����ʲ��ˣ������װ��___________�У���������ճɻҽ���
(2)���ҽ���25mL 2mol/L������Һ�ܽ⣬�������һ���ӣ����˺�μ�����H2O2��Һ��ϡ����100mL��ȡ2mL����5��KSCN��Һ��H2O2�������ɹ�������Һ���ȱ�����ɫ����ɫ��ԭ����_________________________________��
(3)ȡ��ͬŨ�ȵ�___________[����(NH4)2Fe(SO4)2������NH4Fe(SO4)2��]����Һ��2mL���ֱ�μ�5��KSCN��Һ�������벽��(2)����Һ��ɫ��ӽ��ı���ҺŨ��Ϊ0.4��10-3mol/L��
(4)������ɵã�ÿ100g���ʲ����к�����Ԫ�ص�����ԼΪ___________ mg(����1λ��Ч����)��������5%�����ʣ�Ϊ����ÿ��20mg����Ԫ������ÿ����Ҫ�Բ���___________kg��
��.������������(FeC2O4��nH2O)�ķֽ�ʵ��
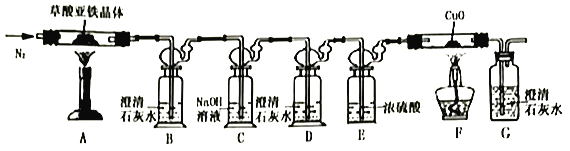
(1)�ӻ����Ƕȿ��ǣ�����ʵ��װ�õ�����ȱ����___________��
(2)ʵ�鿪ʼ��װ��B�г��ֻ���֤���ֽ�����д���CO��������___________������ַ�Ӧ��Ĺ��������Ͷ�뾭��е�ϡ�����У�������ȫ�ܽ���������ų���ȡ��ӦҺ����KSCN��Һ��Ѫ��ɫ��
(3)��ȡ7.2g���������������װ��AӲ�ʲ������У����Ⱥ�(��������跴Ӧ��ȫ)�����װ��AӲ�ʲ������в������2.88g��װ��FӲ�ʲ������й�����������0.64g���������������ֽ�Ļ�ѧ����ʽΪ_________________________________��
���𰸡����� H2O2��SCN-���� NH4Fe(SO4)2 2 20 ȱ��β������װ�� װ��D�в����ֻ��ǣ�װ��G�г��ֻ��ǣ���װ��F�ڹ����ɫ���ɫ FeC2O4��2H2O![]() FeO+CO��+CO2��+2H2O
FeO+CO��+CO2��+2H2O
��������
I.(1)������������Ҫ�������н��У�
(2)��H2O2���е������Է���;
(3)����Fe3+��SCN-��ΪѪ��ɫ������
II.(1)���������������ȷֽ�����һ����̼��һ����̼�ж�����ɢ�������л���Ⱦ������
(2)CO���л�ԭ�ԣ���F���ڼ���ʱ������Ӧ��CuO+CO![]() Cu+CO2��ͨ��D��ʯ��ˮ������ǣ�G��ʯ��ˮ������жϣ�
Cu+CO2��ͨ��D��ʯ��ˮ������ǣ�G��ʯ��ˮ������жϣ�
(3)����������FeO�����������ʵ����������������������ʵ�����F���ٵ�������OԪ�ص�����������CO��CuO��Ӧ�����ʵ�����ϵ�������CO�����ʵ���������CԪ���غ�ɵ�CO2�����ʵ������ٸ��������غ�ɵ�ˮ������������������ʵ����ıȵõ�������������Ļ�ѧʽ����ֽ�Ļ�ѧ����ʽ��
I.(1) �����ʵIJ���ϴ���������װ�������У���������ճɻҽ���
(2)��ϡ�����ܽ�ҽ����������һ���ӣ�ʹ��Ӧ���ֽӴ����ܽ⣬���˳�ȥ����������Һ�еμ�����H2O2��Һ������Һ�е�Fe2+����ΪFe3+������KSCN��Һ����Fe3+�Ĵ��ڣ���H2O2������������H2O2����ǿ�������ԣ��Ὣ��Һ��SCN-����Ϊ(SCN)2���壬ʹ��Һ�ȱ�����ɫ��
(3)�ڲ���(2)����Ԫ�ر�Ϊ+3�۵�Fe3+��Fe3+��KSCN��Һ��Ϊ��ɫ����(NH4)2Fe(SO4)2��FeΪ+2�ۣ���NH4Fe(SO4)2��FeΪ+3�ۣ�����ѡ��ı���ҺΪNH4Fe(SO4)2��100g���˵Ļҽ����Ƴ���100mL��Һ������2mL��Һ�к���Fe�����ʵ���Ϊn=0.4��10-3mol/L��0.002L=8��10-6mol����100g���ʲ����к�����Ԫ�ص�����m(Fe)= 8��10-6mol��![]() =2.24��10-3g=2.24mg��2mg��������5%�����ʣ�Ϊ����ÿ��20mg����Ԫ������ÿ��һ������Fe������Ϊm=20mg��5%=400mg=0.4g������100g���˺���Fe����Ϊ2mg������һ����һ����Ҫ�Բ���(400mg��100)��2=20000g=20kg��
=2.24��10-3g=2.24mg��2mg��������5%�����ʣ�Ϊ����ÿ��20mg����Ԫ������ÿ��һ������Fe������Ϊm=20mg��5%=400mg=0.4g������100g���˺���Fe����Ϊ2mg������һ����һ����Ҫ�Բ���(400mg��100)��2=20000g=20kg��
��.(1)���������������ȷֽ�����FeO��CO��CO2��H2O��һ����̼���ж����壬��ɢ�������л���Ⱦ���������Դӻ����Ƕȿ��ǣ�����ʵ��װ�õ�����ȱ����û�д���β��������
(2)��װ��A�в��������������ȷֽ⣬��Ӧ����ʽ��FeC2O4��2H2O![]() FeO+CO��+CO2��+2H2O������������ͨ��װ��B������CO2���壬Ȼ��ͨ��װ��C���ճ�ȥCO2��Ȼ��ͨ��װ��D����CO2�Ѿ������ɾ�����ͨ��E�е�Ũ�������CO����ĸ����F��CO��CuO�ڼ���ʱ������Ӧ��CuO+CO
FeO+CO��+CO2��+2H2O������������ͨ��װ��B������CO2���壬Ȼ��ͨ��װ��C���ճ�ȥCO2��Ȼ��ͨ��װ��D����CO2�Ѿ������ɾ�����ͨ��E�е�Ũ�������CO����ĸ����F��CO��CuO�ڼ���ʱ������Ӧ��CuO+CO![]() Cu+CO2��������CO2�������Gװ�ã��ɿ�������ʯ��ˮ����ǣ���װ��F�ڹ����ɫ���ɫ���Ӷ���֤����Ӧ������CO���壻
Cu+CO2��������CO2�������Gװ�ã��ɿ�������ʯ��ˮ����ǣ���װ��F�ڹ����ɫ���ɫ���Ӷ���֤����Ӧ������CO���壻
(3)n(FeO)=2.88g��72g/mol=0.04mol������FeԪ���غ��֪����������������ʵ�����0.04mol�����ݷ���ʽCuO+CO![]() Cu+CO2��֪F�м��ٵ�������CuO��OԪ�ص������������ʵ�����CO�����ʵ�����ȣ���n(CO)=n(O)=
Cu+CO2��֪F�м��ٵ�������CuO��OԪ�ص������������ʵ�����CO�����ʵ�����ȣ���n(CO)=n(O)=![]() �����ڲ�����������ֽ�ʱ����CO��CO2�����ʵ�����ȣ�����n(CO2)= n(CO)=0.04mol��m(CO)=0.04mol��28g/mol=1.12g��m(CO2)= 0.04mol��44g/mol=1.76g�����Ը��ݻ�ѧ��Ӧ�����������غ㣬��֪��Ӧ������ˮ��������m(H2O)= 7.2g-2.88g-1.12g-1.76g=1.44g��n(H2O)=1.44g��18g/mol=0.08mol������n(����)��n(FeO)��n(CO)��n(CO2)��n(H2O)=0.04��0.04��0.04��0.04��0.08=1��1��1��1��2�����Բ����������廯ѧʽ��FeC2O4��2H2O�������ʷֽ�Ļ�ѧ����ʽΪ��
�����ڲ�����������ֽ�ʱ����CO��CO2�����ʵ�����ȣ�����n(CO2)= n(CO)=0.04mol��m(CO)=0.04mol��28g/mol=1.12g��m(CO2)= 0.04mol��44g/mol=1.76g�����Ը��ݻ�ѧ��Ӧ�����������غ㣬��֪��Ӧ������ˮ��������m(H2O)= 7.2g-2.88g-1.12g-1.76g=1.44g��n(H2O)=1.44g��18g/mol=0.08mol������n(����)��n(FeO)��n(CO)��n(CO2)��n(H2O)=0.04��0.04��0.04��0.04��0.08=1��1��1��1��2�����Բ����������廯ѧʽ��FeC2O4��2H2O�������ʷֽ�Ļ�ѧ����ʽΪ��![]() FeO+CO��+CO2��+2H2O��
FeO+CO��+CO2��+2H2O��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��ش���������:
��1�� ![]() ��ϵͳ����Ϊ______________;
��ϵͳ����Ϊ______________;
��2��3������2һ��ϩ�Ľṹ��ʽΪ______________;
��3��![]() �ķ���ʽΪ______________;
�ķ���ʽΪ______________;
��4��ij���ķ���ʽΪC4H4,���Ǻϳ����м���,���ж���ͬ���칹��
����д������һ����ʽ�ṹ��ͬ���칹��Ľṹ��ʽ______________.
������һ��ͬ���칹��,ÿ��̼ԭ�Ӿ��ﱥ��,��̼��̼�ļн���ͬ,�÷�����̼ԭ���γɵĿռ乹��Ϊ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. SO2 �� CO2 �ķ������幹�;�Ϊֱ����
B. H2O �� NH3 �е�����ԭ���ӻ���ʽ��ͬ
C. CS2 Ϊ�ռ乹��Ϊ V �εļ��Է���
D. HCN��SiF4 �� SO32- ������ԭ�Ӿ�Ϊ sp3 �ӻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����жԷ��ӵ����ʵĽ����У�����ȷ���ǣ� ��
A. �����������Ȼ�̼������������ˮ��������������ԭ������
B. ���ԣ�H3PO4>HClO����Ϊ H3PO4 �ķ��ǻ���ԭ������ HClO �Ķ�
C. ˮ���ȶ���1000�����ϲŻᲿ�ַֽ⣩����Ϊˮ�к��д������������
D. �����ط���ʽΪ C15H22O5���ṹ��ͼ���÷����а��� 7 ������̼ԭ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֽ���A��B���ԭ���ʱ��A�������������й��ƶ���ȷ����( )
A.A�Ľ�����ǿ��B
B.A�缫�Ϸ����ĵ缫��Ӧ�ǻ�ԭ��Ӧ
C.���Ӳ�����A�缫�����·����B�缫
D.A�ڽ������˳�����һ��������ǰ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CuS��Cu2S���ڴ������Է�ˮ�е�Cr2O72-��Ӧ���¡���ӦI��CuS+Cr2O72-+H+��Cu2++SO42-+Cr3++H2O(δ��ƽ) ��Ӧ��Cu2S+Cr2O72-+H+��Cu2++SO42-+Cr3++H2O(δ��ƽ) �����й�˵����ȷ����
A. ��ӦI�͢��и���2��Ԫ�صĻ��ϼ۷����仯
B. ����1molCr2O72-ʱ��ӦI����������H+�����ʵ������
C. ��Ӧ���л�ԭ���������������ʵ���֮��Ϊ3��5
D. ������ͬʱ��Cu2S��ȥ�������Cr2O72-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в�������εĹ�ͬ���ʵ���
A.���Ǿ���
B.��������ˮ
C.���ȶ���������
D.�������ᷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ԫ�أ����� A��B��C��D Ϊ����������Ԫ�أ�E��F Ϊ��������Ԫ�أ����ǵ�ԭ��������������
A Ԫ��ԭ�ӵĺ��� p �������� s �������� 3 |
B Ԫ���γɵ���������࣬���γɵ�һ�ֹ��嵥�ʹ�ҵ�ϳ������и�� |
C Ԫ�ػ�̬ԭ�� p ����� 3 ��δ�ɶԵ��� |
D ԭ�Ӻ������� p ���ȫ������� |
E �ڸ�������δ�ɶԵ�������� |
F ���γɺ�ɫ����ש��ɫ���ͺ�ɫ������������ |
��������������Ϣ���ش����⣺
��1��A ��±�����ڹ�ҵ������Ҫ���ã�A ������±����ķе����±���ʾ��
±���� | AF3 | ACl3 | ABr3 | AI3 |
�е�/K | 172 | 285 | 364 | 483 |
������±����е��������ߵ�ԭ����_________________��
�� ACl3��LiAH4 ��A ԭ�ӵ��ӻ������������Ϊ______��_______���� A3N3H6 ��Ϊ�ȵ�����ķ��ӵĽṹ��ʽΪ___________��
����AF3���ӽṹ���ͷ�Ӧ AF3(g)+NH4F(s)=NH4AF4(s)�ܹ�������ԭ��_________________��
��2��ijͬѧ����������Ϣ���ƶ�
��B��̬ԭ�ӵĺ��������Ų�Ϊ ����ͬѧ�����ĵ����Ų�ͼΥ����________��
����ͬѧ�����ĵ����Ų�ͼΥ����________��
�� ��֪Ԫ�� B ��һ���⻯������Ҫ�Ļ���ԭ�ϣ����Ѹ��⻯��IJ�����Ϊ����ʯ�ͻ�����չˮƽ�ı�־���йظ��⻯����ӵ�˵����ȷ����________��
A�������к��з��Ӽ���� B�����ں��м��Լ��ķǼ��Է���
C��ֻ����4��sp-s�ĦҼ���1��p-p�Ħм� D�����⻯������� B ԭ�Ӳ��� sp2 �ӻ�
��3��D ��̬ԭ����������ߵĵ��ӣ���������ڿռ���______������ԭ�ӹ����______�Ρ�
��4��д�� E ԭ�ӵĵ����Ų�ʽ______________��
��5����д�� F Ԫ����Χ�����Ų�ʽ_________���� FSO4��Һ�еμ���CԪ���⻯���ˮ��Һ����������ɫ��������������ܽ⣬�õ�����ɫ����Һ����д�������ܽ�����ӷ���ʽ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ������11�������ӵ�17�����������ݱ��ϵ�������( )
A.ԭ�ӵ��Ӳ�������
B.���Ƶ�����������ǿ
C.���������ֵ������
D.�ӹ赽�ȸ��۴�-4��-1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com