
【题目】氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作。
回答下列问题:

(1)①中发生反应的化学方程式为__________。
(2)②中加入试剂Ⅱ的目的是__________。
(3)操作④为蒸发,蒸发的作用之一是得到KCl晶体,另一作用是__________。
(4)某同学称取提纯的产品0.76g,溶解后定容在100mL容量瓶中,取25.00mL溶液,与25.00mL浓度为0.1000mol/L的硝酸银溶液恰好完全反应,则该产品的纯度为__________。
【答案】
(1)BaCl2+K2SO4=BaSO4↓+2KCl;BaCl2+K2CO3=BaCO3↓+2KCl
(2)除去过量的 Ba2+
(3)除去多余的盐酸(4)98%
【解析】
试题分析:氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质,除去碳酸根离子和硫酸根离子,需要加入过量的氯化钡溶液,然后过滤后得到氯化钡、氯化钾的混合溶液A,然后加入过量的碳酸钾溶液,除去氯化钡,过滤得到氯化钾和碳酸钾的混合溶液,再加入过量的盐酸,除去碳酸钾,最后经过加热浓缩,蒸发结晶,过滤得到氯化钾晶体。
(1)①中发生的所有反应是硫酸钾和氯化钡反应生成硫酸钡沉淀和氯化钾,碳酸钾和氯化钡反应生成碳酸钡沉淀和氯化钾,化学方程式为:K2SO4+BaCl2=BaSO4↓+2KCl,K2CO3+BaCl2=BaCO3↓+2KCl,故答案为:K2SO4+BaCl2=BaSO4↓+2KCl,K2CO3+BaCl2=BaCO3↓+2KCl;
(2)②中加入试剂2的目的是除过量BaCl2,故答案为:除过量BaCl2;
(3)E之后需要进行蒸发,蒸发的作用之一是得到KCl晶体,另一作用是:除去多余的盐酸,故答案为:除去多余的盐酸;
(4)设25mL氯化钾溶液中氯化钾的物质的量为nmol。
KCl+AgNO3=AgCl+KNO 3
1mol 1mol
Nmol 0.1000molL-1 ×0.02562L
n=0.002562mol,
100mL溶液中含有氯化钾的物质的量=0.002562mol×4=0.010248mol,
100mL溶液中含有氯化钾的质量=0.010248mol×74.5g/mol=0.764376g,
质量分数=![]() ×100%=98.40%,故答案为:98.40%。
×100%=98.40%,故答案为:98.40%。


科目:高中化学 来源: 题型:
【题目】下列图示与对应叙述相符的是
A.图甲表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
B.图乙表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
C.图丙表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂
D.图丁表示一定浓度Na2CO3溶液中滴加盐酸,生成CO2与滴加盐酸物质的量的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为3L的密闭容器里进行如下反应N2(g)+ 3H2(g)![]() 2NH3(g) ,反应开始时n(N2)=1.5mol, n(H2)=4.4mol, 2min末n(H2) =3.5mol。则:
2NH3(g) ,反应开始时n(N2)=1.5mol, n(H2)=4.4mol, 2min末n(H2) =3.5mol。则:
(1)用NH3的浓度变化来表示该反应的速率为 ;
(2)2min末时N2的浓度为 ;
(3)氮气的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴和碘的化合物在生产和生活中有广泛的用途.
(1)市场销售的某种食用精制盐中含碘酸钾。
①碘酸钾与碘化钾在酸性条件下发生如下反应,配平该反应的化学方程式:
![]()
②上述反应生成的I2可用四氯化碳检验,现象为________________________。
向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
Na2SO3稀溶液与I2反应的离子方程式是________________________。
(2)海水提溴过程中溴元素的变化如下:
![]()
①过程I,海水显碱性,调其pH<3.5后,再通入氯气,调节海水pH可提高C12的利用率,用平衡原理解释其原因是_______________________。
②过程II,用热空气将溴赶出,再用浓Na2CO3溶液吸收。完成并配平下列方程式。
![]()
③过程III,用硫酸酸化可得Br2和Na2SO4的混合溶液。相同条件下,若用盐酸酸化,则所得溴的质量减少,原因是_________________________。
④NaBrO3是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入 2.6molNaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
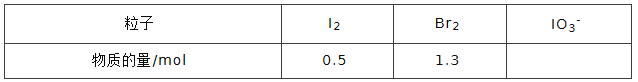
则原溶液中NaI的物质的量为_________mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α1和α2分别为A、B在两个恒容容器中平衡体系A(g)![]() 2B(g)和2A(g)
2B(g)和2A(g)![]() B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是
B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是
A. α1、α2均减小 B. α1、α2均增大
C. α1减小,α2增大 D. α1增大,α2减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y均为有刺激性气味的气体,且几种物质间有以下转化关系,部分产物未标出。请回答下列问题。

(1)写出下列各物质的化学式:X 、Y 、C 。
(2)反应①的化学方程式为 ,反应②的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胰岛素分子有A、B两条肽链,A链有21个氨基酸,B链有30个氨基酸,胰岛素分子中肽键的数目是
A. 48个 B. 49个 C. 50个 D. 51个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中A与B反应生成C,其反应速率分别用v (A)、v (B)、v (C)表示。已知v (A)、v (B)、v (C)之间有以下关系2 v (B)=3 v (A), 3 v (C)=2 v (B)。 则此反应可表示为( )
A. 2A + 3B = 2C B. A+ 3B = 2C
C. 3A + B = 2C D. A + B = C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体。其转化关系如图所示(反应条件和部分产物略去)。下列说法中不正确的是
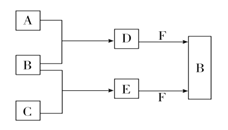
A.F中阴阳离子个数比为1:1
B.化合物F中既有离子键又有共价键
C.合成过程中的反应均是氧化还原反应
D.1mol F与E反应时转移的电子数为NA(NA为阿伏伽德罗常数的值)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com