
【题目】Ⅰ.(化学反应原理)
25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH的电离平衡常数表达式__。
(2)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为__。
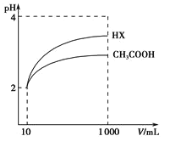
(3)体积均为l00mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数___(填“大于”、“小于”或“等于”)醋酸的电离平衡常数。
Ⅱ.(化学与生活)
防治环境污染,改善生态环境已成为全球共识。
(1)燃煤气化有助于减少PM2.5,写出焦炭与水蒸气反应的化学方程式___。
(2)采用焚烧处理垃圾进行发电已在江苏投入使用。下列是生活中的常见垃圾:
A.废纸 B.废电池 C.易拉罐 D.玻璃瓶 E.塑料制品
在焚烧处理前,除废电池外,还有___(填字母)应剔除并回收,随意丢弃电池造成的主要危害是___。
【答案】Ka= CH3COOH> H2CO3> HClO 大于 C+H2O(g)
CH3COOH> H2CO3> HClO 大于 C+H2O(g) ![]() CO+H2 CD 重金属污染
CO+H2 CD 重金属污染
【解析】
Ⅰ.(1)电离平衡常数为电离后各离子浓度幂之积与未电离的分子的浓度的比值;
(2)电离平衡常数越大,酸的电离程度越大,酸的酸性越强;
(3)酸在稀释时,酸性越强,加水稀释后pH的变化量越大;
Ⅱ.(1)焦炭与水蒸气反应生成CO和H2;
(2)在焚烧处理前,除废电池外,可剔除并回收的是易拉罐和玻璃瓶;废电池主要造成重金属污染。
Ⅰ.(1)CH3COOH的电离平衡常数表达式为Ka= ;
;
(2)电离平衡常数越大,酸的电离程度越大,酸的酸性越强,由表格中数据可知Ka(CH3COOH)>Ka(H2CO3)>Ka(HClO) >Ka(HCO3-),因此三种酸的酸性由强到弱的顺序为;CH3COOH> H2CO3> HClO;
(3)由图象可知,酸HX稀释后pH的变化量大于CH3COOH,所以酸性HX>CH3COOH,因此HX的电离平衡常数大于醋酸的电离平衡常数。
Ⅱ.(1)焦炭与水蒸气反应生成CO和H2,反应方程式为:C+H2O(g) ![]() CO+H2;
CO+H2;
(2)在焚烧处理前,除废电池外,可剔除并回收的是易拉罐和玻璃瓶,选择CD;废电池主要造成重金属污染。


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】(1)已知:2N2O5(g )=2N2O4( g )+O2( g ) H1=-4.4kJ·mol-1
2NO2( g)=N2O4(g ) H2 =-55.3kJ·mol-1
则反应N2O5( g )=2NO2(g )+![]() O2(g )的H=_______ kJ·mol-1
O2(g )的H=_______ kJ·mol-1
(2)2molCH3OH(l)在O2(g)中完全燃烧,生成CO2(g)和H2O(l),放出887kJ热量:请写出CH3OH燃烧热的热化学方程式__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,直线交点处的圆圈为NaCl晶体中Na+或Cl-所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。

(1)请将其中代表Na+的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体结构示意图______________。
(2)晶体中,在每个Na+的周围与它最接近的且距离相等的Na+共有________个。
(3)在NaCl晶胞中正六面体的顶角上、面上、棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-的个数等于________,即________(填计算式);Na+的个数等于________,即________(填计算式)。
(4)设NaCl的摩尔质量为Mrg·mol-1,食盐晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA。食盐晶体中两个距离最近的钠离子间的距离为____________________________________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:SiO2(s) +4HF(g)![]() SiF4(g)+ 2H2O(g) ΔH =-148.9kJ/mol。
SiF4(g)+ 2H2O(g) ΔH =-148.9kJ/mol。
(1)在地壳深处容易有_____气体逸出,在地壳浅处容易有_____沉积。
(2)如果上述反应的平衡常数K值变大,该反应_____(选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,___。
a.2v正(HF)=v逆(H2O) b.v(H2O)=2v(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将锌片和铜片按图示方式插入柠檬中,电流计指针发生偏转。下列针对该装置的说法正确的是( )

A.将电能转换为化学能
B.电子由铜片流出经导线到锌
C.一段时间后,锌片质量减轻
D.铜片一侧柠檬变蓝色,产生Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为:CH4+2O2+2KOU=K2CO3+3H2O,下列说法正确的是( )
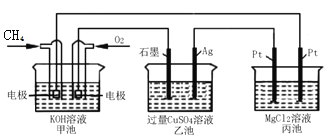
A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池中正极的电极反应式是O2+4e-+4H+=2H2O
C. 反应过程中,乙池的pH逐渐减小
D. 甲池中消耗O2的体积与丙池生成气体的总体积在相同条件下的比值为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是地壳中含量仅次于铝的金属元素.铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)磁铁矿是工业上冶炼铁的原料之一,其原理是![]() ,若有
,若有![]() 参加反应,转移电子的物质的量是 ______ mol.
参加反应,转移电子的物质的量是 ______ mol.
(2)高铁酸钾![]() 是一种既能杀菌、消毒,又能絮凝净水的水处理剂.工业制备高铁酸钾的方法为在KOH浓溶液中加入NaClO和
是一种既能杀菌、消毒,又能絮凝净水的水处理剂.工业制备高铁酸钾的方法为在KOH浓溶液中加入NaClO和![]() ,并不断搅拌,其发生的反应的离子方程式
,并不断搅拌,其发生的反应的离子方程式![]() ______
______
(3)某课外活动小组将下图所示装置按一定顺序连接,在实验室里制取一定量的FeCl3(所通气体过量并充分反应)已知FeCl3会吸水潮解.

请回答下列问题:
①![]() 中发生反应的化学方程式为 ______ .
中发生反应的化学方程式为 ______ .
②各装置的正确连接顺序为![]() 填写装置代号A
填写装置代号A![]() ______
______ ![]() ______
______ ![]() ______
______ ![]() ______
______![]() D。
D。![]() 其中C用了两次
其中C用了两次![]()
③装置E的作用是 ______ ,写出装置D中反应的离子方程式 ______ .
④反应开始后,B中硬质玻璃管内的现象为 ______ ;FeCl3常作净水剂,原理是 ______ ![]() 用离子方程式表示
用离子方程式表示![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为某化学小组设计的一个用于探究电解原理的实验装置,其中X为阳离子交换膜。下列有关说法正确的是
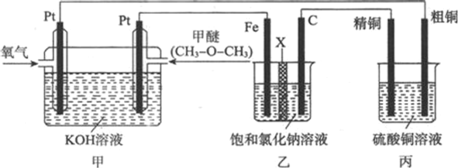
A.通入甲醚的电扳上发生的电极反应式为![]()
B.乙装置中C电极上生成氢气
C.反应一段时间后,向乙中加入几滴酚酞试液,铁电极附近溶液变红色
D.反应一段时间后,丙装置中两个电极上的质量变化量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有机物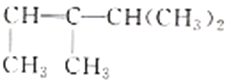 的系统命名是__________,将其在催化剂存在下完全氢化,所得烷烃的系统命名是__________。
的系统命名是__________,将其在催化剂存在下完全氢化,所得烷烃的系统命名是__________。
(2)有机物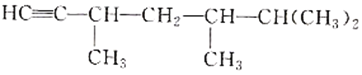 的系统命名是________,将其在催化剂下完全氢化,所得烷烃的系统命名是__________。
的系统命名是________,将其在催化剂下完全氢化,所得烷烃的系统命名是__________。
(3)3-苯基-1-丙烯的结构简式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com