
【题目】如图为某化学小组设计的一个用于探究电解原理的实验装置,其中X为阳离子交换膜。下列有关说法正确的是
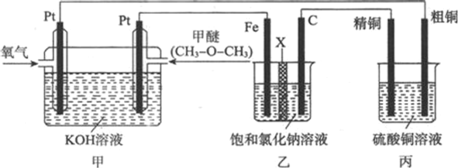
A.通入甲醚的电扳上发生的电极反应式为![]()
B.乙装置中C电极上生成氢气
C.反应一段时间后,向乙中加入几滴酚酞试液,铁电极附近溶液变红色
D.反应一段时间后,丙装置中两个电极上的质量变化量相等
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】含氧有机物甲可用来制取多种有用的化工产品,合成路线如图:

已知:Ⅰ.RCHO
Ⅱ.RCOOH![]() RCOCl
RCOCl![]() RCOOR’(R、R’代表烃基)
RCOOR’(R、R’代表烃基)
(1)甲的含氧官能团的名称是___。写出检验该官能团常用的一种化学试剂的名称___。
(2)写出己和丁的结构简式:己__,丁__。
(3)乙有多种同分异构体,属于甲酸酯,含酚羟基,且酚羟基与酯的结构在苯环邻位的同分异构体共有___种。
(4)在NaOH溶液中发生水解反应时,丁与辛消耗NaOH的物质的量之比为__。
(5)庚与M合成高分子树脂的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(化学反应原理)
25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH的电离平衡常数表达式__。
(2)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为__。
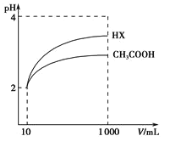
(3)体积均为l00mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数___(填“大于”、“小于”或“等于”)醋酸的电离平衡常数。
Ⅱ.(化学与生活)
防治环境污染,改善生态环境已成为全球共识。
(1)燃煤气化有助于减少PM2.5,写出焦炭与水蒸气反应的化学方程式___。
(2)采用焚烧处理垃圾进行发电已在江苏投入使用。下列是生活中的常见垃圾:
A.废纸 B.废电池 C.易拉罐 D.玻璃瓶 E.塑料制品
在焚烧处理前,除废电池外,还有___(填字母)应剔除并回收,随意丢弃电池造成的主要危害是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,含有少量氧化铁,利用明矾石制备K2SO4的工艺流程如图所示:

据此流程图回答下列问题:
(1)①焙烧炉中Al2(SO4)3与S反应的产物是两种氧化物,该反应的化学方程式为______;写出炉气的一种用途________。
(2)②中Al2O3参与反应的离子方程式为__________。
(3)③中调节pH不能用CO2的理由是____________________。
(4)工业冶炼金属铝需要定期更换补充阳极碳块的原因是__________________。
(5)纯净氢氧化铝经历两次__________________(填反应类型)可制得铝。以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池负极的电极反应式是__________________。
(6)现有明矾石1 625 t,按上述流程制得780 t Al(OH)3,忽略铝元素的损失,请计算明矾石中钾元素的质量分数为____________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.23 g金属钠投入到100 mL水中,使其充分反应,假设反应后溶液的体积不变。试计算:
(1)反应后所得溶液溶质的物质的量浓度是多少?
_____________________________________________
(2)产生标准状况下的气体多少毫升?
________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度下(T=500K),有相同体积的甲、乙两容器,且保持体积不变,甲容器中充入1gSO2和1gO2,乙容器中充入2gSO2和2gO2。下列叙述中错误的是( )
A.化学反应速率:乙>甲B.平衡时O2的浓度:乙>甲
C.平衡时SO2的转化率:乙>甲D.平衡时SO2的体积分数:乙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2HI(g) ![]() H2(g) +I2(g),下列叙述能够说明己达平衡状态的是
H2(g) +I2(g),下列叙述能够说明己达平衡状态的是
A. 混合气体的颜色不再变化
B. 温度和体积一定时,容器内压强不再变化
C. lmolH-H键生成的同时有2molH-I键断裂
D. 各物质的物质的量浓度之比为2:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。

①实验1、2研究的是__________对H2O2分解速率的影响。
②实验2、3的目的是_______________对H2O2分解速率的影响。
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:

①定性如图甲可通过观察_______,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是_________。
②定量如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是__________。
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是______热反应,导致_______________;
②从影响化学反应速率的因素看,你认为还可能是________的影响。要证明你的猜想,实验方案是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂醛(![]() )是一种食用香精,广泛应用丁牙膏、糖果及调味品中。苯甲醛和乙醛生成肉桂醛过程如下:下列说法正确的是( )
)是一种食用香精,广泛应用丁牙膏、糖果及调味品中。苯甲醛和乙醛生成肉桂醛过程如下:下列说法正确的是( )
Ⅰ.![]() +CH3CHO
+CH3CHO![]()
Ⅱ.![]() +H2O
+H2O
A.1molCH3CHO和环氧乙烷(![]() )混合物中含共用电子对数目为7NA
)混合物中含共用电子对数目为7NA
B.肉桂醛和苯甲醛互为同系物
C.肉桂醛中所有原子不可能在同一平面上
D.检验乙醛中是否有肉桂醛的方法:加入溴水,看是否褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com