
【题目】将0.23 g金属钠投入到100 mL水中,使其充分反应,假设反应后溶液的体积不变。试计算:
(1)反应后所得溶液溶质的物质的量浓度是多少?
_____________________________________________
(2)产生标准状况下的气体多少毫升?
________________________________________________
【答案】0.1mol/L 112mL
【解析】
钠与水发生反应:2Na +2H2O=2NaOH+H2↑;已知0.23gNa(物质的量为0.01mol),根据反应关系即可计算出n(NaOH),c(NaOH),V(H2)。
钠与水发生反应产生氢氧化钠和氢气,反应的化学方程式是:2Na +2H2O=2NaOH+H2↑,根据反应方程式可知:23g钠发生反应会产生1molNaOH和0.5molH2,则0.23gNa反应产生NaOH的物质的量是0.01mol,反应产生氢气的物质的量是0.005mol;
(1)由于水的体积是100mL,反应后溶液的体积不变,所以c(NaOH)= ![]() =0.1mol/L;
=0.1mol/L;
(2)根据v=nVm可知,反应产生的0.005mol的氢气在标准状况下的体积是V(H2)= 0.005mol×22.4L/mol=0.112L=112mL。


 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】元素A、B、C都是短周期元素,它们的原子序数大小为A<B<C。A元素原子的最外层电子数为次外层电子数的2倍;B元素原子的次外层电子数是最外层电子数的2倍。B与C可形成共价化合物BC4。请回答下列问题:
(1)这三种元素所对应的气态氢化物中最不稳定的是__________(填化学式),该氢化物在空气中燃烧的化学方程式为__________________________________________________________。
(2)它们的最高价氧化物对应的水化物中酸性最强的是__________,最弱的是__________(填酸的化学式)。
(3)BC4的化学式是__________。BC4不稳定,遇水易形成B的含氧酸及C的氢化物。近代海战中为了掩蔽军事目标,通常采用喷BC4和液氨的方法以形成烟幕,有关化学反应用方程式表示为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将锌片和铜片按图示方式插入柠檬中,电流计指针发生偏转。下列针对该装置的说法正确的是( )

A.将电能转换为化学能
B.电子由铜片流出经导线到锌
C.一段时间后,锌片质量减轻
D.铜片一侧柠檬变蓝色,产生Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是地壳中含量仅次于铝的金属元素.铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)磁铁矿是工业上冶炼铁的原料之一,其原理是![]() ,若有
,若有![]() 参加反应,转移电子的物质的量是 ______ mol.
参加反应,转移电子的物质的量是 ______ mol.
(2)高铁酸钾![]() 是一种既能杀菌、消毒,又能絮凝净水的水处理剂.工业制备高铁酸钾的方法为在KOH浓溶液中加入NaClO和
是一种既能杀菌、消毒,又能絮凝净水的水处理剂.工业制备高铁酸钾的方法为在KOH浓溶液中加入NaClO和![]() ,并不断搅拌,其发生的反应的离子方程式
,并不断搅拌,其发生的反应的离子方程式![]() ______
______
(3)某课外活动小组将下图所示装置按一定顺序连接,在实验室里制取一定量的FeCl3(所通气体过量并充分反应)已知FeCl3会吸水潮解.

请回答下列问题:
①![]() 中发生反应的化学方程式为 ______ .
中发生反应的化学方程式为 ______ .
②各装置的正确连接顺序为![]() 填写装置代号A
填写装置代号A![]() ______
______ ![]() ______
______ ![]() ______
______ ![]() ______
______![]() D。
D。![]() 其中C用了两次
其中C用了两次![]()
③装置E的作用是 ______ ,写出装置D中反应的离子方程式 ______ .
④反应开始后,B中硬质玻璃管内的现象为 ______ ;FeCl3常作净水剂,原理是 ______ ![]() 用离子方程式表示
用离子方程式表示![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G、H、I是中学化学中常见的九种化合物,其中B常温下为无色无味透明的液体,C的焰色反应火焰呈黄色,E是红棕色的固体;X、Y是两种常见的单质,其中X常温常压下为气体.
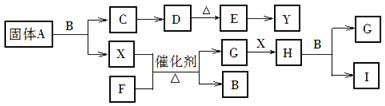
根据上面框图关系回答下列问题:
(1)A的化学式为______,常温下A的颜色为______,I的化学式为______.
(2)写出X+F![]() G+B的化学方程式:______.
G+B的化学方程式:______.
(3)写出实验室中用两种固体药品制取F气体的化学方程式:______.
(4)写出“![]() ”反应的离子方程式:______.
”反应的离子方程式:______.
(5)写出“![]() 金属单质
金属单质 两性氧化物”的化学方程式:______.
两性氧化物”的化学方程式:______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为某化学小组设计的一个用于探究电解原理的实验装置,其中X为阳离子交换膜。下列有关说法正确的是
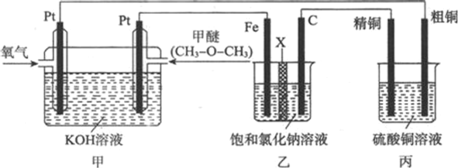
A.通入甲醚的电扳上发生的电极反应式为![]()
B.乙装置中C电极上生成氢气
C.反应一段时间后,向乙中加入几滴酚酞试液,铁电极附近溶液变红色
D.反应一段时间后,丙装置中两个电极上的质量变化量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列装置中,MSO4和NSO4是两种常见金属的易溶盐。当K闭合时,SO42-从右到左通过交换膜移向M极,下列分析正确的是( )

A.溶液中c(M2+)减小
B.N的电极反应式:N-2e-=N2+
C.X电极上有H2产生,发生还原反应
D.反应过程中Y电极周围生成白色胶状沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态水。已知室温下2g SiH4自燃放出热量89.2kJ。SiH4自燃的热化学方程式为______________________________。
(2)写出用惰性电极电解饱和食盐水的总电解离子方程式:_________________。
(3)写出用惰性电极电解硫酸铜溶液的总化学方程式:___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,可以用来合成很多有机物如甲醇(CH3OH)、二甲醚(CH3OCH3)等,还可以作燃料。
(1)在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇: CO(g)+2H2(g) ![]() CH3OH(g) △H<0
CH3OH(g) △H<0
① 该反应的平衡常数表达式为____________。
② 若容器容积不变,下列措施可增加甲醇产率的是___________。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1 mol CO和3 mol H2
(2)已知:① CO(g)+2H2(g) ![]() CH3OH(g) △H1 =-90.7 kJ·mol-1
CH3OH(g) △H1 =-90.7 kJ·mol-1
② 2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) △H2 =-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2 =-23.5 kJ·mol-1
③ CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H3 =-41.2 kJ·mol-1
CO2(g)+H2(g) △H3 =-41.2 kJ·mol-1
则 3CO(g)+3H2(g) ![]() CH3OCH3(g)+CO2(g)的 △H =_______kJ·mol-1
CH3OCH3(g)+CO2(g)的 △H =_______kJ·mol-1
(3)甲醇也是新能源电池的燃料,但它对水质会造成一定的污染。有一种电化学法可消除这种污染。其原理是: 2滴甲醇,1mL 1.0mol·L—1硫酸,4mL 0.1mol·L—1硫酸钴 (CoSO4)混合溶液,插上两根惰性电极,通电,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用图装置模拟上述过程:

① 检验电解时产生的CO2气体,井穴板穴孔内应盛放___________溶液。
② 写出净化甲醇的离子方程式______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com