
【题目】铁是地壳中含量仅次于铝的金属元素.铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)磁铁矿是工业上冶炼铁的原料之一,其原理是![]() ,若有
,若有![]() 参加反应,转移电子的物质的量是 ______ mol.
参加反应,转移电子的物质的量是 ______ mol.
(2)高铁酸钾![]() 是一种既能杀菌、消毒,又能絮凝净水的水处理剂.工业制备高铁酸钾的方法为在KOH浓溶液中加入NaClO和
是一种既能杀菌、消毒,又能絮凝净水的水处理剂.工业制备高铁酸钾的方法为在KOH浓溶液中加入NaClO和![]() ,并不断搅拌,其发生的反应的离子方程式
,并不断搅拌,其发生的反应的离子方程式![]() ______
______
(3)某课外活动小组将下图所示装置按一定顺序连接,在实验室里制取一定量的FeCl3(所通气体过量并充分反应)已知FeCl3会吸水潮解.

请回答下列问题:
①![]() 中发生反应的化学方程式为 ______ .
中发生反应的化学方程式为 ______ .
②各装置的正确连接顺序为![]() 填写装置代号A
填写装置代号A![]() ______
______ ![]() ______
______ ![]() ______
______ ![]() ______
______![]() D。
D。![]() 其中C用了两次
其中C用了两次![]()
③装置E的作用是 ______ ,写出装置D中反应的离子方程式 ______ .
④反应开始后,B中硬质玻璃管内的现象为 ______ ;FeCl3常作净水剂,原理是 ______ ![]() 用离子方程式表示
用离子方程式表示![]()
【答案】8 ![]() MnO2+4HCl(浓)
MnO2+4HCl(浓)![]() MnCl2+Cl2+2H2O E C B C 吸收氯气中的氯化氢
MnCl2+Cl2+2H2O E C B C 吸收氯气中的氯化氢 ![]() 产生棕色的烟
产生棕色的烟 ![]()
![]() 胶体
胶体![]()
【解析】
(1)若有1molFe3O4参加反应,由反应可知4molCO作还原剂,利用C元素的化合价变化计算转移电子;
(2)KOH浓溶液中加入NaClO和Fe(OH)3,生成K2FeO4,Fe元素的化合价升高,则Cl元素的化合价降低,结合电子、电荷守恒分析;
(3)由制备实验装置可知,A中发生4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O,然后利用E除去HCl,利用C干燥氯气,在B中发生Fe与氯气的反应生成氯化铁,连接C可防止氯化铁水解,最后利用D进行尾气处理,以此来解答。
MnCl2+Cl2↑+2H2O,然后利用E除去HCl,利用C干燥氯气,在B中发生Fe与氯气的反应生成氯化铁,连接C可防止氯化铁水解,最后利用D进行尾气处理,以此来解答。
(1)1molFe304参加反应,Fe原子得电子,而C原子失去电子,4molCO作还原剂,则转移的电子为4mol×(4-2)=8mol,故答案为:8;
(2)KOH浓溶液中加入NaClO和Fe(OH)3,生成K2FeO4,Fe元素的化合价升高,则Cl元素的化合价降低,由电子、电荷守恒可知,离子反应为2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O,故答案为:2FeO42-+3Cl-+5H2O;
(3)①A中发生反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
②制备氯气中含有氯化氢和水蒸气,除去氯化氢气体用饱和食盐水,除去水蒸气用浓硫酸,应先除氯化氢,后干燥,还要防止氯化铁水解,最后吸收尾气中未反应的氯气,防止污染空气,所以装置顺序为A→E→C→B→C→D,故答案为:E;C;B;C;
③E的作用为吸收氯气中的氯化氢,D中的离子反应为2OH-+Cl2=Cl-+ClO-+H2O,故答案为:吸收氯气中的氯化氢;2OH-+Cl2=Cl-+ClO-+H2O;
④反应开始后,B中硬质玻璃管内的现象为产生棕色的烟,FeCl3常作净水剂,原理是Fe3++3H2OFe(OH)3+3H+,
故答案为:产生棕色的烟;Fe3++3H2OFe(OH)3(胶体)+3H+。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大危害,必须进行处理.常用的处理方法有两种.方法1:还原沉淀法.
该法的工艺流程为:
其中第①步存在平衡2CrO42(黄色)+2H+Cr2O32(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显______色.
(2)能说明第①步反应达平衡状态的是_____(填序号)
A.Cr2O72和CrO42的浓度相同
B.2v(Cr2O72)=v(CrO42)
C.溶液的颜色不变
(3)第②步中,还原1molCr2O72离子,需要______mol的FeSO47H2O.
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至______.
方法2:电解法.
该法用Fe做电极电解含Cr2O72的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生
Cr(OH)3沉淀.
(5)用Fe做电极的原因为______(用电极反应式解释).
(6)在阴极附近溶液pH升高,溶液中同时生成的沉淀还有______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】各可逆反应达平衡后,改变反应条件,其变化趋势正确的是
A.CH3COOH![]() CH3COO-+H+(忽略溶液体积变化)
CH3COO-+H+(忽略溶液体积变化)
B.FeCl3+3KSCN![]() Fe(SCN)3+3KCl(忽略溶液体积变化)
Fe(SCN)3+3KCl(忽略溶液体积变化)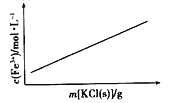
C.N2(g)+3H2(g) ![]() 2NH3(g)(恒温恒压)
2NH3(g)(恒温恒压) 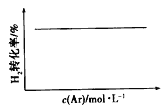
D.CH3OCH3(g)+3H2O(g) ![]() 6H2(g)+2CO2(g) △H>0(密闭容器,恒压)
6H2(g)+2CO2(g) △H>0(密闭容器,恒压)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(化学反应原理)
25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH的电离平衡常数表达式__。
(2)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为__。
(3)体积均为l00mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数___(填“大于”、“小于”或“等于”)醋酸的电离平衡常数。
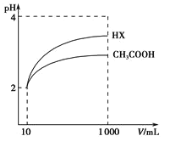
Ⅱ.(化学与生活)
防治环境污染,改善生态环境已成为全球共识。
(1)燃煤气化有助于减少PM2.5,写出焦炭与水蒸气反应的化学方程式___。
(2)采用焚烧处理垃圾进行发电已在江苏投入使用。下列是生活中的常见垃圾:
A.废纸 B.废电池 C.易拉罐 D.玻璃瓶 E.塑料制品
在焚烧处理前,除废电池外,还有___(填字母)应剔除并回收,随意丢弃电池造成的主要危害是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,含有少量氧化铁,利用明矾石制备K2SO4的工艺流程如图所示:

据此流程图回答下列问题:
(1)①焙烧炉中Al2(SO4)3与S反应的产物是两种氧化物,该反应的化学方程式为______;写出炉气的一种用途________。
(2)②中Al2O3参与反应的离子方程式为__________。
(3)③中调节pH不能用CO2的理由是____________________。
(4)工业冶炼金属铝需要定期更换补充阳极碳块的原因是__________________。
(5)纯净氢氧化铝经历两次__________________(填反应类型)可制得铝。以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池负极的电极反应式是__________________。
(6)现有明矾石1 625 t,按上述流程制得780 t Al(OH)3,忽略铝元素的损失,请计算明矾石中钾元素的质量分数为____________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.23 g金属钠投入到100 mL水中,使其充分反应,假设反应后溶液的体积不变。试计算:
(1)反应后所得溶液溶质的物质的量浓度是多少?
_____________________________________________
(2)产生标准状况下的气体多少毫升?
________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2HI(g) ![]() H2(g) +I2(g),下列叙述能够说明己达平衡状态的是
H2(g) +I2(g),下列叙述能够说明己达平衡状态的是
A. 混合气体的颜色不再变化
B. 温度和体积一定时,容器内压强不再变化
C. lmolH-H键生成的同时有2molH-I键断裂
D. 各物质的物质的量浓度之比为2:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是:( )
A.加入合金的质量不可能为6.4g
B.沉淀完全时消耗NaOH溶液的体积为120mL
C.溶解合金时收集到NO气体的体积在标准状况下为2.24L
D.参加反应的硝酸的物质的量为0.2mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com