
【题目】各可逆反应达平衡后,改变反应条件,其变化趋势正确的是
A.CH3COOH![]() CH3COO-+H+(忽略溶液体积变化)
CH3COO-+H+(忽略溶液体积变化)
B.FeCl3+3KSCN![]() Fe(SCN)3+3KCl(忽略溶液体积变化)
Fe(SCN)3+3KCl(忽略溶液体积变化)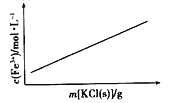
C.N2(g)+3H2(g) ![]() 2NH3(g)(恒温恒压)
2NH3(g)(恒温恒压) 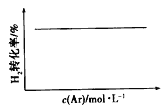
D.CH3OCH3(g)+3H2O(g) ![]() 6H2(g)+2CO2(g) △H>0(密闭容器,恒压)
6H2(g)+2CO2(g) △H>0(密闭容器,恒压)
【答案】D
【解析】
A、CH3COOH溶液中加入CH3COONa固体,使CH3COOH溶液中CH3COO-浓度增加,电离平衡逆向移动,则c(H+)减小,pH逐渐增大,与图中不符合,选项A错误;
B、因该反应中K+、Cl-实际不参加反应,则加入KCl对平衡体系无影响,化学平衡不移动,铁离子的浓度不变,与图中不符合,选项B错误;
C、恒温恒压,加入Ar,各反应物的物质的量不变,体积变大,各物质的量浓度成倍减小(等效于减压),化学平衡朝体积增大方向移动,H2的改变量减小,起始量不变,转化率减小,图中不符合,选项C错误;
D、因反应为吸热反应,则体积、压强不变时,升高温度,平衡正向移动,则甲醚的转化率增大,与图中相符合,选项D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】制备乙酸乙酯的绿色合成路线之一为 :下列说法正确的是( )
:下列说法正确的是( )
A.M的分子式为![]() B.淀粉与纤维素互为同分异构体
B.淀粉与纤维素互为同分异构体
C.![]() 的反应类型属于取代反应D.N的结构简式为
的反应类型属于取代反应D.N的结构简式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A、B、C都是短周期元素,它们的原子序数大小为A<B<C。A元素原子的最外层电子数为次外层电子数的2倍;B元素原子的次外层电子数是最外层电子数的2倍。B与C可形成共价化合物BC4。请回答下列问题:
(1)这三种元素所对应的气态氢化物中最不稳定的是__________(填化学式),该氢化物在空气中燃烧的化学方程式为__________________________________________________________。
(2)它们的最高价氧化物对应的水化物中酸性最强的是__________,最弱的是__________(填酸的化学式)。
(3)BC4的化学式是__________。BC4不稳定,遇水易形成B的含氧酸及C的氢化物。近代海战中为了掩蔽军事目标,通常采用喷BC4和液氨的方法以形成烟幕,有关化学反应用方程式表示为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,直线交点处的圆圈为NaCl晶体中Na+或Cl-所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。

(1)请将其中代表Na+的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体结构示意图______________。
(2)晶体中,在每个Na+的周围与它最接近的且距离相等的Na+共有________个。
(3)在NaCl晶胞中正六面体的顶角上、面上、棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-的个数等于________,即________(填计算式);Na+的个数等于________,即________(填计算式)。
(4)设NaCl的摩尔质量为Mrg·mol-1,食盐晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA。食盐晶体中两个距离最近的钠离子间的距离为____________________________________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,将xmL pH=a的稀NaOH溶液与ymL pH=b的稀盐酸充分反应。下列关于反应后溶液pH的判断,正确的是( )
A. 若x=y,且a+b=14,则pH>7B. 若10x=y,且a+b=13,则pH=7
C. 若ax=by,且a+b=13,则pH=7D. 若x=10y,且a+b=14,则pH>7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:SiO2(s) +4HF(g)![]() SiF4(g)+ 2H2O(g) ΔH =-148.9kJ/mol。
SiF4(g)+ 2H2O(g) ΔH =-148.9kJ/mol。
(1)在地壳深处容易有_____气体逸出,在地壳浅处容易有_____沉积。
(2)如果上述反应的平衡常数K值变大,该反应_____(选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,___。
a.2v正(HF)=v逆(H2O) b.v(H2O)=2v(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将锌片和铜片按图示方式插入柠檬中,电流计指针发生偏转。下列针对该装置的说法正确的是( )

A.将电能转换为化学能
B.电子由铜片流出经导线到锌
C.一段时间后,锌片质量减轻
D.铜片一侧柠檬变蓝色,产生Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是地壳中含量仅次于铝的金属元素.铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)磁铁矿是工业上冶炼铁的原料之一,其原理是![]() ,若有
,若有![]() 参加反应,转移电子的物质的量是 ______ mol.
参加反应,转移电子的物质的量是 ______ mol.
(2)高铁酸钾![]() 是一种既能杀菌、消毒,又能絮凝净水的水处理剂.工业制备高铁酸钾的方法为在KOH浓溶液中加入NaClO和
是一种既能杀菌、消毒,又能絮凝净水的水处理剂.工业制备高铁酸钾的方法为在KOH浓溶液中加入NaClO和![]() ,并不断搅拌,其发生的反应的离子方程式
,并不断搅拌,其发生的反应的离子方程式![]() ______
______
(3)某课外活动小组将下图所示装置按一定顺序连接,在实验室里制取一定量的FeCl3(所通气体过量并充分反应)已知FeCl3会吸水潮解.

请回答下列问题:
①![]() 中发生反应的化学方程式为 ______ .
中发生反应的化学方程式为 ______ .
②各装置的正确连接顺序为![]() 填写装置代号A
填写装置代号A![]() ______
______ ![]() ______
______ ![]() ______
______ ![]() ______
______![]() D。
D。![]() 其中C用了两次
其中C用了两次![]()
③装置E的作用是 ______ ,写出装置D中反应的离子方程式 ______ .
④反应开始后,B中硬质玻璃管内的现象为 ______ ;FeCl3常作净水剂,原理是 ______ ![]() 用离子方程式表示
用离子方程式表示![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态水。已知室温下2g SiH4自燃放出热量89.2kJ。SiH4自燃的热化学方程式为______________________________。
(2)写出用惰性电极电解饱和食盐水的总电解离子方程式:_________________。
(3)写出用惰性电极电解硫酸铜溶液的总化学方程式:___________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com