
【题目】制备乙酸乙酯的绿色合成路线之一为 :下列说法正确的是( )
:下列说法正确的是( )
A.M的分子式为![]() B.淀粉与纤维素互为同分异构体
B.淀粉与纤维素互为同分异构体
C.![]() 的反应类型属于取代反应D.N的结构简式为
的反应类型属于取代反应D.N的结构简式为![]()
【答案】C
【解析】
制备乙酸乙酯的绿色合成路线:以淀粉或纤维素为原料,经水解生成葡萄糖,葡萄糖在酒化酶作用下生成乙醇,乙醇被氧化生成乙醛,进一步氧化生成乙酸,乙醇、乙酸发生酯化反应生成乙酸乙酯,
A.淀粉或纤维素水解最终产物为葡萄糖,所以M为葡萄糖,分子式为C6H12O6,故A错误;
B.同分异构体是指分子式相同,结构不同的化合物.淀粉和纤维素的化学式均为(C6H10O5)n,但n值范围不同,分子式不同,故B错误;
C.④的反应是酸和醇反应CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,本质是酸脱羟基醇脱氢,反应类型属于酯化反应,也属于取代反应,故C正确;
CH3COOCH2CH3+H2O,本质是酸脱羟基醇脱氢,反应类型属于酯化反应,也属于取代反应,故C正确;
D.纤维素水解得到葡萄糖M,葡萄糖氧化得到乙醇,乙醇氧化得到乙酸N,N的结构简式为CH3COOH,故D错误;
故选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏伽德罗常数的值,下列说法正确的有
为阿伏伽德罗常数的值,下列说法正确的有
①![]() 和
和![]() 在
在![]() 存在的条件下于密闭容器中加热充分反应后,容器内物质分子数等于
存在的条件下于密闭容器中加热充分反应后,容器内物质分子数等于![]()
②![]() 甲基
甲基![]() 所含电子数为
所含电子数为![]()
③在精炼铜或电镀铜的过程中,当阴极析出32g铜转移电子数均为![]()
④含![]() 的浓硫酸与足量铜反应,生成
的浓硫酸与足量铜反应,生成![]() 的分子数为
的分子数为![]()
⑤![]() 白磷晶体中含有的
白磷晶体中含有的![]() 键数是
键数是![]()
⑥![]() 的
的![]() 和
和![]() 混合物中,含硫原子总数为
混合物中,含硫原子总数为![]()
⑦![]() 过氧化钡
过氧化钡![]() 固体中阴、阳离子总数为
固体中阴、阳离子总数为![]()
A.2个B.3个C.4个D.5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示一个电解池,装有电解液a、X、Y是两块电极板,通过导线与直流电源相连,请回答以下问题:

(1)若X、Y是惰性石墨电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴石蕊试液,在X极附近观察到的现象是______________________________;Y电极上的电极反应式是 ___________________,电解NaCl溶液的离子方程式是________________________________。
(2)若要在铜制品上镀Ag,则电解质溶液a可为___________________,Y电极反应式为_________________________________。
(3)若上图装置中的电源为甲醇—空气—KOH溶液的燃料电池,则电池负极的电极反应式_________________,电池工作过程中,正极附近的pH将______(填“增大、减小或不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是![]()
A.相同条件下,正戊烷、异戊烷、新戊烷的沸点依次增大
B.矿物油和植物油都是有机物,均不能使溴水褪色
C.甲苯和![]() 光照下的反应与乙醇和乙酸的反应不属于同一类型的反应
光照下的反应与乙醇和乙酸的反应不属于同一类型的反应
D.聚乙炔是以乙炔为单体发生加聚反应形成的高聚物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容中发生下列反应aA(g)![]() cC(s)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(s)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时D的浓度为原平衡的1.8倍,下列叙述正确的是
( )
A.A的转化率变小B.平衡向正反应方向移动
C.D的体积分数变大D.可能a > d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g) ![]() 2N2(g)+3H2O
2N2(g)+3H2O![]()
在恒容的密闭容器中,下列有关说法正确的是
A. 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B. 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C. 单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡
D. 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大危害,必须进行处理.常用的处理方法有两种.方法1:还原沉淀法.
该法的工艺流程为:
其中第①步存在平衡2CrO42(黄色)+2H+Cr2O32(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显______色.
(2)能说明第①步反应达平衡状态的是_____(填序号)
A.Cr2O72和CrO42的浓度相同
B.2v(Cr2O72)=v(CrO42)
C.溶液的颜色不变
(3)第②步中,还原1molCr2O72离子,需要______mol的FeSO47H2O.
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至______.
方法2:电解法.
该法用Fe做电极电解含Cr2O72的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生
Cr(OH)3沉淀.
(5)用Fe做电极的原因为______(用电极反应式解释).
(6)在阴极附近溶液pH升高,溶液中同时生成的沉淀还有______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】各可逆反应达平衡后,改变反应条件,其变化趋势正确的是
A.CH3COOH![]() CH3COO-+H+(忽略溶液体积变化)
CH3COO-+H+(忽略溶液体积变化)
B.FeCl3+3KSCN![]() Fe(SCN)3+3KCl(忽略溶液体积变化)
Fe(SCN)3+3KCl(忽略溶液体积变化)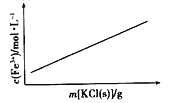
C.N2(g)+3H2(g) ![]() 2NH3(g)(恒温恒压)
2NH3(g)(恒温恒压) 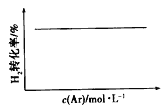
D.CH3OCH3(g)+3H2O(g) ![]() 6H2(g)+2CO2(g) △H>0(密闭容器,恒压)
6H2(g)+2CO2(g) △H>0(密闭容器,恒压)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com