
【题目】在密闭容中发生下列反应aA(g)![]() cC(s)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(s)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时D的浓度为原平衡的1.8倍,下列叙述正确的是
( )
A.A的转化率变小B.平衡向正反应方向移动
C.D的体积分数变大D.可能a > d
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为:CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显色_________。
(2)能说明第①步反应达平衡状态的是___________。
A.Cr2O72-和CrO42-的浓度相同 B.2v(Cr2O72-)=v(CrO42-) C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要_________mol的FeSO47H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH)=1032,要c(Cr3+)降至105mol/L,溶液的pH应调至_________________。
Cr3+(aq)+3OH(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH)=1032,要c(Cr3+)降至105mol/L,溶液的pH应调至_________________。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为____________。
(6)在阴极附近溶液pH升高的原因是__________(用电极反应解释),溶液中同时生成的沉淀还有_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为1L的密闭容器中![]() 体积不变
体积不变![]() 充入
充入![]() 和
和![]() ,一定条件下发生反应:
,一定条件下发生反应:![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化如图所示。下列说法正确的是
的浓度随时间变化如图所示。下列说法正确的是
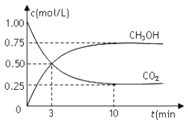
A.从反应开始到平衡,氢气的平均反应速率为![]()
B.进行到3min时,正反应速率和逆反应速率相等
C.10min后容器中各物质的量浓度不再改变
D.到达平衡状态时,反应放出![]() 的能量
的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Mg片和Al片为电极,并用导线连接,同时插入NaOH溶液中,下列说法正确的是
A.Mg片作负极,电极反应:Mg-2e- ![]() Mg2+
Mg2+
B.Al片作负极,电极反应:Al+4OH- -3e- ![]() AlO2- +2H2 O
AlO2- +2H2 O
C.电子从Mg电极沿导线流向Al电极
D.Al片上有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备乙酸乙酯的绿色合成路线之一为 :下列说法正确的是( )
:下列说法正确的是( )
A.M的分子式为![]() B.淀粉与纤维素互为同分异构体
B.淀粉与纤维素互为同分异构体
C.![]() 的反应类型属于取代反应D.N的结构简式为
的反应类型属于取代反应D.N的结构简式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中通入A、B两种气体,在一定条件下使之发生如下反应:2A(g)+B(g)![]() 2C(g)(正反应为放热反应),达到平衡后,改变一个条件(x)(横坐标),下列(y)(纵坐标)一定符合图中所示变化关系的是( )
2C(g)(正反应为放热反应),达到平衡后,改变一个条件(x)(横坐标),下列(y)(纵坐标)一定符合图中所示变化关系的是( )

①x表示温度,y表示C的质量
②x表示压强,y表示混合气体的平均相对分子质量
③x表示再加入A的质量,y表示A的百分含量
④x表示再加入A的质量,y表示A的转化率
⑤x表示再加入A的质量,y表示B的转化率
⑥x表示温度,y表示B的转化率
A.①③⑤B.②③⑤C.③④⑤D.④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:2N2O5(g )=2N2O4( g )+O2( g ) H1=-4.4kJ·mol-1
2NO2( g)=N2O4(g ) H2 =-55.3kJ·mol-1
则反应N2O5( g )=2NO2(g )+![]() O2(g )的H=_______ kJ·mol-1
O2(g )的H=_______ kJ·mol-1
(2)2molCH3OH(l)在O2(g)中完全燃烧,生成CO2(g)和H2O(l),放出887kJ热量:请写出CH3OH燃烧热的热化学方程式__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验淀粉水解的产物,设计如下实验方案:
![]()
请回答下列问题:
(1)试剂1为20%的H2SO4溶液,其作用是_________;
(2)试剂2为_________NaOH溶液,其作用是_________,使检验水解产物的实验得以顺利进行;发生反应的离子方程式为:_________;
(3)反应①的化学方程式为_________;
(4)为检验淀粉液是否已完全水解,取少量水解液于试管中,加入碘水,则证明淀粉未完全水解的现象是_________;
(5)如果实验过程中没有加入试剂2而直接加入试剂3,能否实现实验目的_________(填”能”或”否”)否,若不能,其原因是_________硫酸能溶解Cu(OH)2而使实验失败,最简单的改正措施是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:SiO2(s) +4HF(g)![]() SiF4(g)+ 2H2O(g) ΔH =-148.9kJ/mol。
SiF4(g)+ 2H2O(g) ΔH =-148.9kJ/mol。
(1)在地壳深处容易有_____气体逸出,在地壳浅处容易有_____沉积。
(2)如果上述反应的平衡常数K值变大,该反应_____(选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,___。
a.2v正(HF)=v逆(H2O) b.v(H2O)=2v(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com