
| A、氧化铁、硫酸铜、硫酸 |
| B、盐酸、空气、纯碱 |
| C、硝酸、胆矾、熟石灰 |
| D、醋酸、食盐水、烧碱 |


科目:高中化学 来源: 题型:
| A、4.6g钠与足量水反应,生成Na+离子的数目为0.2NA |
| B、标准状况下,4.48L水中含有H2O分子的数目为0.2NA |
| C、0.3mol 氯气中含有Cl原子的数目为0.3NA |
| D、0.2 mol/L CaCl2溶液中含有Clˉ离子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用8%的盐酸蒸发浓缩获得30%的盐酸 |
| B、光纤和餐桌上的瓷盘都是硅酸盐制品 |
| C、可利用丁达尔效应来区别淀粉溶液和氯化钠溶液 |
| D、二氧化硫具有漂白性,与氯水混合使用漂白效果更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、原子结构示意图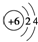 可以表示12C,也可以表示14C 可以表示12C,也可以表示14C |
B、比例模型 可以表示二氧化碳分子,也可以表示水分子 可以表示二氧化碳分子,也可以表示水分子 |
C、结构示意图为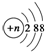 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 |
D、电子式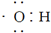 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 取适量固体与试管中,加适量蒸馏水使其溶解, |
| 实验一:取黄豆大小的Na与冷水反应;取表面积比Na大的、刚打磨过的Mg条与热水反应,观察反应现象; | 现象:Na与水反应比Mg与水反应剧烈; 结论:金属性:Na>Mg; |
| 实验二: | 现象: 结论: |
查看答案和解析>>
科目:高中化学 来源: 题型:
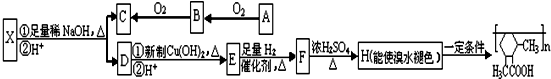
查看答案和解析>>
科目:高中化学 来源: 题型:
| X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
| Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
| Z元素的族序数是其周期数的三倍 |
| W原子的第一至第六电离能分别为:I1=578KJ?mol-1 I2=1817KJ?mol-1 I3=2745KJ?mol-1I4=11575KJ?mol-1 I5=14830KJ?mol-1 I6=18376KJ?mol-1 |
| Q为前四周期中电负性最小的元素 |
| 元素R位于周期表的第10列 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com