
| X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
| Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
| Z元素的族序数是其周期数的三倍 |
| W原子的第一至第六电离能分别为:I1=578KJ?mol-1 I2=1817KJ?mol-1 I3=2745KJ?mol-1I4=11575KJ?mol-1 I5=14830KJ?mol-1 I6=18376KJ?mol-1 |
| Q为前四周期中电负性最小的元素 |
| 元素R位于周期表的第10列 |

| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、氧化铁、硫酸铜、硫酸 |
| B、盐酸、空气、纯碱 |
| C、硝酸、胆矾、熟石灰 |
| D、醋酸、食盐水、烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
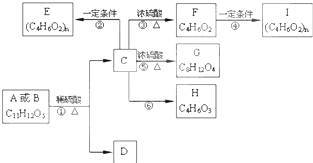 两种有机物A、B的分子式均为C11H12O5,均能发生如图变化.
两种有机物A、B的分子式均为C11H12O5,均能发生如图变化.查看答案和解析>>
科目:高中化学 来源: 题型:
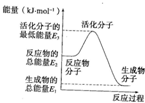 已知:①H2O(g)═H2O(l)△H2=-44kJ?mol-1
已知:①H2O(g)═H2O(l)△H2=-44kJ?mol-1| A、反应②中的能量变化如图所示,则△H2=E1-E3 |
| B、H2的燃烧热为△H=-241.8kJ?mol-1 |
| C、由反应③知在温度一定的条件下,在一恒容密闭容器中通入1molN2和3molH2,反应后放出的热量为92.4kJ |
| D、反应③中加入催化剂,通过降低反应所需的活化能来增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某溶液加AgNO3溶液生成白色沉淀,说明原溶液中有Cl- |
| B、某溶液加BaCl2溶液生成白色沉淀,说明原溶液中有SO42- |
| C、某溶液加NaOH溶液生成蓝色沉淀,说明原溶液中有Cu2+ |
| D、某溶液加KOH溶液生成红褐色沉淀,说明原溶液中有Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
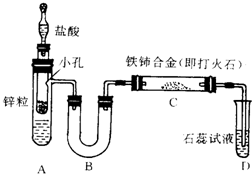 已知亚硝酸铵很不稳定,在溶液中加热能分解生成氮气和水.有人设计以下装置(A中盛有饱和NaNO2与NH4Cl的混合溶液)来进行有关实验.
已知亚硝酸铵很不稳定,在溶液中加热能分解生成氮气和水.有人设计以下装置(A中盛有饱和NaNO2与NH4Cl的混合溶液)来进行有关实验.查看答案和解析>>
科目:高中化学 来源: 题型:
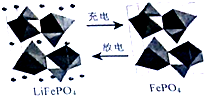 锂是制造化学和电源的重要原料,如LiFePO4电池某电极的工作原理如图所示,下列有关说法正确的是( )
锂是制造化学和电源的重要原料,如LiFePO4电池某电极的工作原理如图所示,下列有关说法正确的是( )| A、充电时该电极为阴极 |
| B、放电时该电极的反应式为FePO4+e-+Li+=LiFePO4 |
| C、放电时Li+向负极移动 |
| D、该电池可以用硫酸溶液作电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纸层折法分离Fe3+和Cu2+的实验中,点样后的滤纸需晾干后可使用 |
| B、在中和热测定的实验中,可将反应前氢氧化钠溶液的温度作为起始温度 |
| C、将Kcl和NaNO3的混合液加热并浓缩至有晶体析出时,趁热过滤可分离得NaCl晶体 |
| D、(镀锌铁皮锌镀层厚度的测定)实验中,当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,借此可判断锌镀层是否反应完全 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com