
下列中心原子的杂化轨道类型和分子几何构型不正确的是
A.PCl3中P原子sp3杂化,为三角锥形 B.BCl3中B原子sp2杂化,为平面三角形
C.CS2中C原子sp杂化,为直线形 D.H2S分子中,S为sp杂化,为直线形
科目:高中化学 来源: 题型:
下列说法正确的是( )
A、我国自主研发的“龙芯1号”CPU芯片与光导纤维是同种材料
B、需要通过化学反应才能从海水中获得食盐和淡水
C、水晶项链和餐桌上的瓷盘都是硅酸盐制品
D、粗硅制备单晶硅涉及氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
技术的发展与创新永无止境,我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如图K39-4:

图K39-4
(1)向沉淀池中要通入CO2和氨气,应选通入______ (填化学式)。原因是_________________________________________。
(2)沉淀池中发生反应的化学方程式是__________________________________。
(3)母液中的溶质主要是________。向母液中通氨气加入细小食盐颗粒,冷却析出副产品,通入氨气的作用是_____________________________________________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了________(填上述流程中的编号)的循环,物质X是__________,从沉淀池中提取沉淀的操作是__________ 。
(5)写出煅烧炉中发生反应的化学方程式_____________________________。
(6)这样制得的产品碳酸钠中可能含有的杂质是____________(填化学式),为检验该杂 质的存在,具体操作是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
以Fe为阳极,Pt为阴极,对足量的 Na2SO4 溶液进行电解,一段时间后得到4 mol Fe(OH)3沉淀,此间共消耗水的物质的量为 ( )
A.6mol B.8mol C.10mol D.12mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Be在周期表中位于Al的左上方,则下列有关Be的说法中错误的是
A.单质Be与酸或碱反应都能放出氢气 B.Be(OH)2为两性氢氧化物
C.Be的氧化物的化学式为Be2O3 D.BeCl2属于共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
根据部分短周期元素的原子半径及主要化合价信息,判断以下叙述正确的是
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、—2 | —2 |
A.氢化物的沸点为H2T<H2R B.金属性强弱:L<Q
C.M与T形成的化合物的化学式是Al2O3 D.L2+与R2-的核外电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制取CO2一般分为五个步骤:①检查装置的气密性;②连接、组装仪器;③
向长颈漏斗中注入稀盐酸;④向锥形瓶中放入大理石;⑤收集气体。正确的操作顺序
是( )
A.①②③④⑤ B.①②④③⑤
C. ②①③④⑤ D.②①④③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
碳酸锂广泛应用于陶瓷和医药等领域。以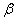 -锂辉石(主要成分为Li2O
-锂辉石(主要成分为Li2O Al2O3
Al2O3 4SiO2)为原材料制备Li2CO3的工艺流程如下:
4SiO2)为原材料制备Li2CO3的工艺流程如下:

已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g.
(1)步骤Ⅰ前,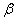 -锂辉石要粉碎成细颗粒的目的是_____________.
-锂辉石要粉碎成细颗粒的目的是_____________.
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入_____________(填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的PH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
(3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有______________.
(4)步骤Ⅲ中,生成沉淀的离子方程式为________________.
(5)从母液中可回收的主要物质是_____________.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com