
| 1.95g |
| 78g/mol |


科目:高中化学 来源: 题型:
| A、在FeCl3溶液中投入足量的Zn粉:2Fe3++Zn═Zn2++2Fe2+ |
| B、Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
| C、磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+8H+═Fe2++2Fe3++4H2O |
| D、NaHSO4溶液与Ba(OH)2溶液混合后呈中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将饱和氯水滴到淀粉碘化钾试纸上,如果试纸先变蓝后变白,说明氯水具有漂白性 |
| B、将SO2通入含HClO的溶液中,生成H2SO4说明HClO酸性比H2SO4强 |
| C、铁钉放在浓硝酸中浸泡后,在用蒸馏水冲洗,然后放入CuSO4溶液中不反应,说明铁钉表面形成了一层致密稳定的氧化铜 |
| D、FeCl3溶液可与腐蚀线路板上的Cu,说明Fe的金属活性大于Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1molCuO |
| B、0.1molCuCO3 |
| C、0.1molCu(OH)2 |
| D、0.1molCu2(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
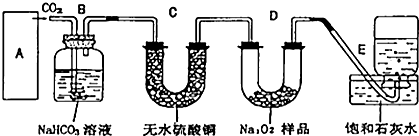
 如图装置,将液体A逐滴加入固体B中,下列叙述正确的是( )
如图装置,将液体A逐滴加入固体B中,下列叙述正确的是( )| A、若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 |
| B、若A为醋酸,B为贝壳,C中盛澄清石灰水,则C中溶液变浑浊 |
| C、若A为浓氨水,B为生石灰,C中盛A1C13溶液,则C中先产生白色沉淀后沉淀又溶解 |
| D、实验仪器D可以起到防止溶液倒吸的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、检验亚硫酸钠试样是否变质:试样
| ||||||||
B、从氧化铝、二氧化硅混合物中提取氧化铝:氧化铝(二氧化硅)
| ||||||||
C、除去氯化钠晶体中少量硝酸钾:试样
| ||||||||
D、从含有Ca2+、SO42-的粗盐中提取NaCl:粗盐水
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com