
【题目】某学生将一小块钠投入滴有酚酞的水中,此实验能证明钠下面4点性质中的( )
①钠比水轻 ②钠的熔点较低 ③钠与水反应在时要放出热量 ④钠与水反应后溶液呈碱性
A.①④B.①②④C.①③④D.①②③④
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】下列离子在溶液中可以大量共存的是
A.Na+、Fe3+、SO42-、SCN-B.K+ 、OH-、AlO2-、Cl-
C.H+ 、Na+、Fe2+、MnO4-D.Na+、H+、HCO3-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnCO3可用于制备活性电极材料MnO2。以菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料制备碳酸锰粗产品的流程如下:

已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp[Al(OH)3]=4.0×10-34。
②氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
(1)“酸浸”过程中不能用浓盐酸替代硫酸,原因是_________________________________。
(2)用离子方程式表示“氧化”过程中加MnO2的目的:_______________________________。
(3)“调pH”时,向含有硫酸铁和硫酸铝的混合溶液中滴加氢氧化钠溶液至两种沉淀共存,当c(Fe3+)=1.0×10-5mol·L-1时,c(Al3+)=______________mol·L-1。
(4)①“沉锰”过程中,反应的离子方程式为_____________________。
②“沉锰”过程中沉锰速率与温度的关系如图所示。当温度高于60℃时,沉锰速率随着温度升高而减慢的原因可能是_____________________________。

(5)从滤液3中可分离出一种不含碳元素的氮肥,它的化学式为_____________________________。
(6)工业上,可以将碳酸锰制成硫酸锰,再用惰性电极电解酸性硫酸锰溶液来制备活性二氧化锰,电解时的阳极反应式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 一定条件下,乙酸乙酯、葡萄糖、蛋白质都能与水发生水解反应
B. 蛋白质溶液中加入饱和硫酸铵溶液,蛋白质发生变性
C. 全降解塑料![]() 可由环氧丙烷
可由环氧丙烷![]() 和CO2缩聚制得
和CO2缩聚制得
D. 植物秸杆的主要成分是纤维素,纤维素在催化剂作用下经水解可得葡萄糖,葡萄糖在酒化酶的作用下能转化为酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED系列产品是一类新型节能产品。图甲是NaBH4/H2O2燃料电池,图乙是LED发光二极管的装置示意图。下列叙述错误的是

A.电池A极区的电极反应式为:H2O2+2e-=2OH-
B.电池放电过程中,Na+从负极区向正极区移动
C.每有1mol NaBH4参加反应转移电子数为4NA
D.要使LED发光二极管正常发光,图乙中的导线a应与图甲中的B极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个容积均为1.12 L的容器,在同温同压下,一个盛满N2,另一个盛满CO气体,则两容器内气体的关系错误的是
A.气体分子数均为3.01×1022B.密度相等
C.原子数相等D.电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验流程探究海带中碘的制取。甲、乙两种实验方案如下:
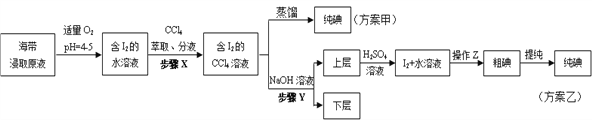
已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
(1)分液漏斗使用前须检漏,检漏方法为_____________
(2)步骤X中,萃取后分液漏斗内观察到的现象是_____________
(3)下列有关步骤Y的说法,正确的是_____________
A.应控制NaOH溶液的浓度和体积 B.将碘转化成离子进入水层
C.操作Z的名称是过滤 D.NaOH溶液可以由乙醇代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),5min后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是 0.15 mol/(Lmin)。
xC(g)+2D(g),5min后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是 0.15 mol/(Lmin)。
(1)B的反应速率v(B)=__________________X=____________
(2)A在5min末的浓度是________________
(3)此时容器内的压强与开始时之比为:___________。
(4)二氯化硫(S2Cl2)是一种琥珀色液体,是合成硫化染料的重要原料。
a. 写出它的电子式______________;
b. 指出它分子内的键型______________。
c. 指出硫元素的化合价为______________。
(5)硒的原子序数为34,硒的单质及其化合物用途非常广泛。
a.硒在元素周期表中的位置是___________。Se2Cl2常用作分析试剂,其结构式为_______。
b.硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是________(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
c.推测SeO2的化学性质(任写一条即可)_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示为元素周期表的一部分,参照元素①~⑨在表中的位置,请回答下列问题:
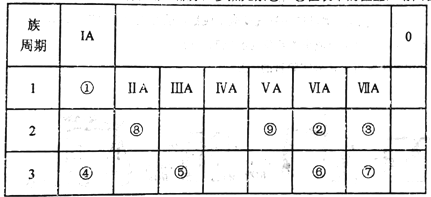
(1)③、④、⑦的原子半径由大到小的顺序是___________(用元素符号表示)。
(2)下列事实能说明②元素的非金属性比⑥元素的非金属性强的是_______。
A.②的单质与⑥元素的简单氢化物溶液反应,溶液变浑浊
B.在氧化还原反应中,1mol②单质比lmo1⑥单质得电子多
C.②和⑥两元素的简单氢化物受热分解,前者的分解温度高。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式____________________。
(4)已知周期表中存在对角相似规则,如铍(Be)与铝化学性质相似,⑧的氧化物、氢氧化物也有两性,写出⑧的氢氧化物与④的最高价氧化物的水化物反应的化学方程式_____________。
(5)已知W+X=Y+Z (反应需要加热,),W、X、Y、Z分别是由①②⑨三种元素形成的四种10电子粒子(W、X为离子,Y、Z为分子),写出该化学方程式______________。
(6)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
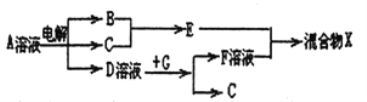
①写出D溶液与G反应的离子方程式_______________。
②写出检验A溶液中溶质的阴离子的方法_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com