
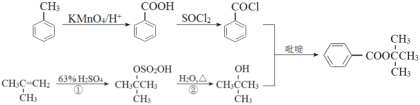
【题目】某化学兴趣小组利用酰卤的醇解制备酯的合成路线如图:
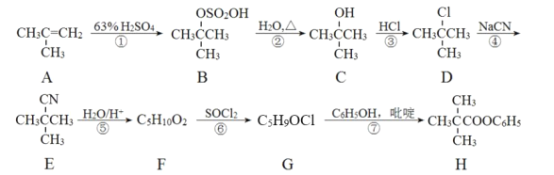
回答下列问题:
(1)A的名称为__(系统命名法),①、⑥的反应类型分别是__、__。
(2)写出②的反应方程式__。
(3)D中官能团的名称是__。
(4)G的结构简式为__。
(5)化合物W与H互为同系物,分子式为C10H12O2,满足以下条件,化合物W的同分异构体有__种,写出其中核磁共振氢谱为5组峰的物质的结构简式___。
a.苯环上有两个取代基 b.遇FeCl3溶液显紫色 c.可以发生银镜反应
(6)写出以甲苯和A为起始原料(其他试剂任选),制备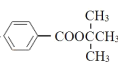 的合成路线:___。
的合成路线:___。
【答案】2—甲基丙烯 加成反应 取代反应 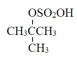 +H2O
+H2O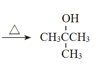 +H2SO4 氯原子
+H2SO4 氯原子 ![]() 15
15 ![]()
【解析】
根据流程分析,A生成B为加成反应,B经过反应成异丁醇,异丁醇经取代生成D,D取代生成E,F在分子组成上比E多了两个氧原子和一个氢原子,少了一个氮原子,推测F可能为(CH3)3CCOOH,F发生取代反应生成G,G的结构简式为(CH3)3CCOCl,G经取代反应生成H。
(1)根据A的结构简式可知,其系统命名法的名称为2—甲基丙烯,A生成B为加成反应,F生成G为取代反应。
(2)根据流程图中B和C的结构简式可知,②的反应方程式为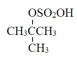 +H2O
+H2O +H2SO4。
+H2SO4。
(3)由D的结构简式可知,其官能团的名称为氯原子。
(4)由H是由G和C6H5OH经取代反应得来的,可推断G的结构简式为![]() 。
。
(5)化合物W与H互为同系物,分子式为C10H12O2,W遇FeCl3溶液显紫色说明含酚羟基,可以发生银镜反应说明含有醛基,再根据苯环上有两个取代基可得W存在的同分异构体有15种,结构简式如下:
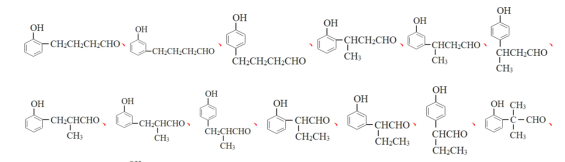
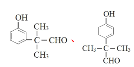 ;其中核磁共振氢谱为5组峰的物质的结构简式为
;其中核磁共振氢谱为5组峰的物质的结构简式为![]() 。
。
(6)要制备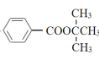 ,采用逆推法,需合成得到
,采用逆推法,需合成得到![]() 和
和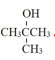 ,由
,由![]() 逆推需要合成
逆推需要合成![]() ,
,![]() 在酸性高锰酸钾作用下得到
在酸性高锰酸钾作用下得到![]() ,可由
,可由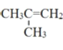 制备
制备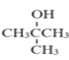 ,故合成路线如下:
,故合成路线如下: 。
。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】根据图填空。
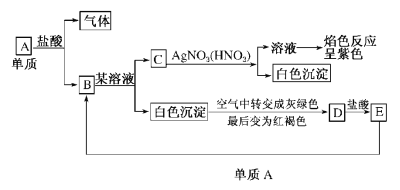
(1)写出下列各物质的化学式:
A__________,B__________,C__________,
D__________,E__________。
(2)写出生成D的反应方程式_____________________________。
(3)写出E→B的离子方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
A | B | C | D |
|
|
|
|
升高温度,正反应方向平衡常数减小 | 0~3s内,反应速率为:v(NO2)=0.2 mol·L-1·s-1 | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4·7H2O),流程如下:
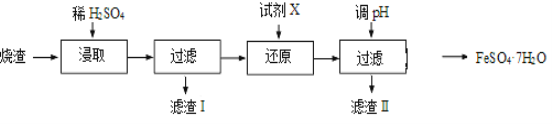
(1)浸取时,溶液中的Fe2+易被空气中的O2氧化,其离子方程式为__________________。能提高烧渣浸取速率的措施有__________________(填字母)。
A.将烧渣粉碎 B.降低硫酸的浓度 C.适当升高温度
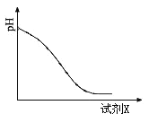
(2)还原时,试剂X的用量与溶液pH的变化如图所示,则试剂X可能是________(填字母)。还原结束时,溶液中的主要阴离子有_____________。
A.Fe粉 B.SO2 C.NaI
(3)滤渣Ⅱ主要成分的化学式为__________________;由分离出滤渣Ⅱ后的溶液得到产品,进行的操作是_______________________________ 、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na+浓度为0.5mol·L-1的某澄清溶液中,还可能含有下表中的若干种离子。
阳离子 | K+ Ag+ Mg2+ Ba2+ |
阴离子 | NO3- CO32- Cl- SO42- |
现取该溶液100mL进行如下实验(气体体积均在标准状况下测定)。
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀硝酸 | 放出标准状况下0.56L无色气体 |
Ⅱ | 向Ⅰ的反应混合液中加入过量的硝酸钡,产生白色沉淀,对沉淀洗涤、干燥,称量所得固体质量 | 固体质量为9.32克 |
Ⅲ | 向Ⅱ的滤液中滴加硝酸银溶液 | 无明显现象 |
请回答下列问题。
(1)实验Ⅰ能确定一定不存在的离子是___。
(2)实验Ⅰ中生成气体的离子方程式为___。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)。___
阴离子 | NO3- | CO32- | Cl- | SO42- |
c/mol·L-1 |
(4)判断K+是否存在,若存在求其最小浓度,若不存在说明理由:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO42H2O)是一种金属腐蚀抑制剂。如图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图。
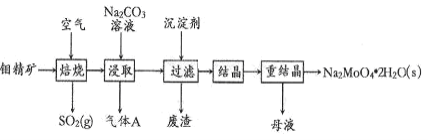
(1) Na2MoO42H2O中钼元素的化合价是_____;在焙烧炉中,空气从炉底进入,矿石经粉碎后从炉顶进入,这样处理的目的是_____
(2)“焙烧”时MoS2转化为MoO3,写出该反应的化学方程式:_____,反应中氧化产物是_____(填化学式)。
(3)“浸取”时含钼化合物发生反应的离子方程式为___________;“结晶”前需向滤液中加入Ba(OH)2固体以除去CO32-。若滤液中c(MoO42-)= 0.40 mol L-1,c(CO32-)= 0.10 molL-1,当BaMoO4开始沉淀时,CO32-的去除率是_____% [已知:Ksp(BaCO3)=1×10-9,Ksp(BaMoO4)=4.0×l0-8]。
(4)“分析纯”的钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与流程中所产生的气体一起通入水中,得到正盐的化学式为_____。
(5)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示:

①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为_____
②碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL FeI2溶液中逐渐通入C12,其中n(I2)、n(Fe3+)随通入n(C12)的变化如图所示,下列说法不正确的是

A. 氧化性强弱:I2<Fe3+
B. n(Cl2)=0.12mol时,溶液中的离子主要有Fe2+、Fe3+、Clˉ
C. 由图可知,该FeI2溶液的浓度为1mol· L-l
D. n(C12):n(FeI2)=1:2时,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:

请回答下列问题:
(1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有______(填离子符号)。
(2)操作②中反应的离子方程式:__________________________________。
(3)操作③中反应的离子方程式:__________________________________。
(4)操作④中一系列处理的操作步骤:过滤、______、灼烧、_______、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为______g。(用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校研究小组的同学们以甲苯和乙醇为主要原料,按下列路线合成一种重要的医药中间体——乙酰基扁桃酰氯。
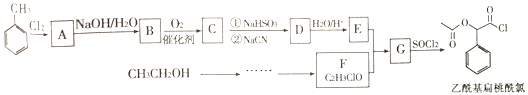
已知: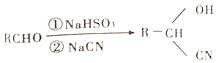 ;
;![]() ;
;![]()
(1)甲苯与氯气反应生成![]() 的条件是______;
的条件是______;![]() 中含有的官能团是_____;
中含有的官能团是_____;![]() 的结构简式是____。
的结构简式是____。
(2)下列说法正确的是______。
a 化合物![]() 不能发生取代反应
不能发生取代反应
b 乙酰基扁桃酰氯属于芳香烃
c 化合物![]() 能与新制的
能与新制的![]() 发生反应
发生反应
(3)![]() 的化学方程式是________。
的化学方程式是________。
(4)化合物![]() 有多种同分异构体,同时符合下列条件的同分异构体共有__种,写出其中一种同分异构体的结构简式____。
有多种同分异构体,同时符合下列条件的同分异构体共有__种,写出其中一种同分异构体的结构简式____。
①红外光谱检测表明分子中含有氰基(![]() );②核磁共振氢谱检测表明分子中有苯环,且苯环上有两种不同化学环境的氢原子。
);②核磁共振氢谱检测表明分子中有苯环,且苯环上有两种不同化学环境的氢原子。
(5)参照上述流程图,以乙醇为原料制备![]() ,设计合成路线____:(无机试剂任选)。
,设计合成路线____:(无机试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com