
【题目】钼酸钠晶体(Na2MoO42H2O)是一种金属腐蚀抑制剂。如图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图。
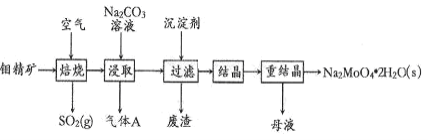
(1) Na2MoO42H2O中钼元素的化合价是_____;在焙烧炉中,空气从炉底进入,矿石经粉碎后从炉顶进入,这样处理的目的是_____
(2)“焙烧”时MoS2转化为MoO3,写出该反应的化学方程式:_____,反应中氧化产物是_____(填化学式)。
(3)“浸取”时含钼化合物发生反应的离子方程式为___________;“结晶”前需向滤液中加入Ba(OH)2固体以除去CO32-。若滤液中c(MoO42-)= 0.40 mol L-1,c(CO32-)= 0.10 molL-1,当BaMoO4开始沉淀时,CO32-的去除率是_____% [已知:Ksp(BaCO3)=1×10-9,Ksp(BaMoO4)=4.0×l0-8]。
(4)“分析纯”的钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与流程中所产生的气体一起通入水中,得到正盐的化学式为_____。
(5)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示:

①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为_____
②碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是_____。
【答案】+6 增大固气接触面积,加快反应速率,提高原料利用率 2MoS2+7O2![]() 2MoO3+4SO2 MoO3、SO2 MoO3+CO32-=MoO42-+CO2↑ 90% (NH4)2CO3、(NH4)2SO3 1:1 酸浓度较低时,Cl-对碳钢的腐蚀作用大于SO42-,使碳钢在盐酸中的腐蚀速率明显快于硫酸,随着酸浓度增大,硫酸会使钢铁钝化,腐蚀速率减慢
2MoO3+4SO2 MoO3、SO2 MoO3+CO32-=MoO42-+CO2↑ 90% (NH4)2CO3、(NH4)2SO3 1:1 酸浓度较低时,Cl-对碳钢的腐蚀作用大于SO42-,使碳钢在盐酸中的腐蚀速率明显快于硫酸,随着酸浓度增大,硫酸会使钢铁钝化,腐蚀速率减慢
【解析】
“焙烧”:氧气将MoS2、PbS氧化成MoO3、PbO、SO2;“浸取”:主要反应为MoO3和Na2CO3溶液反应生成Na2MoO4和CO2;“过滤”:Ba(OH)2将过量的CO32-转化为BaCO3沉淀,通过“过滤”将BaCO3、PbO除去;“结晶”:通过蒸发浓缩、冷却结晶、过滤得到粗Na2MoO42H2O固体;通过“重结晶”得Na2MoO42H2O,据此解答。
(1)根据化合物中元素化合价代数和为0可知Na2MoO42H2O中钼元素的化合价为+6价,矿石经粉碎及从炉顶进入可增大固气接触面积,加快反应速率,同时使原料中的MoS2尽可能反应,提高原料利用率,故答案为:+6;增大固气接触面积,加快反应速率,提高原料利用率;
(2)“焙烧”:氧气将MoS2氧化成MoO3、SO2,反应的方程式为:2MoS2+7O2![]() 2MoO3+4SO2,氧化产物为MoO3、SO2,故答案为:2MoS2+7O2
2MoO3+4SO2,氧化产物为MoO3、SO2,故答案为:2MoS2+7O2![]() 2MoO3+4SO2;MoO3、SO2;
2MoO3+4SO2;MoO3、SO2;
(3)“浸取”:主要反应为MoO3和Na2CO3溶液反应生成Na2MoO4和CO2,反应的离子方程式为:MoO3+CO32-=MoO42-+CO2↑。Ksp(BaMoO4)=4.0×10-8,c(MoO42-)=0.40 mol L-1,由Ksp(BaMoO4=![]() 得:当BaMoO4开始沉淀时,c(Ba2+)=
得:当BaMoO4开始沉淀时,c(Ba2+)=![]() =10-7mol/L,由Ksp(BaCO3)=
=10-7mol/L,由Ksp(BaCO3)=![]() 得,此时溶液中c(CO32-)=
得,此时溶液中c(CO32-)=![]() =10-2mol/L,所以,CO32-的去除率=
=10-2mol/L,所以,CO32-的去除率=![]() ,故答案为:MoO3+CO32-=MoO42-+CO2↑;90%;
,故答案为:MoO3+CO32-=MoO42-+CO2↑;90%;
(4)(NH4)2MoO4和NaOH反应生成Na2MoO4、H2O和NH3,流程中产生的气体为SO2、CO2,SO2、NH3、CO2通入水中可产生(NH4)2CO3、(NH4)2SO3两种正盐,故答案为:(NH4)2CO3、(NH4)2SO3;
(5)①由图可知,碳素钢的缓蚀效果最优时,钼酸钠和月桂酰肌氨酸的浓度都为150mg/L,即二者浓度比为1:1,故答案为:1:1;
②从图上看,相同浓度的盐酸比相同浓度的硫酸腐蚀碳钢的速率大的多,一方面,二者的阴离子不同,可能是酸浓度较低时,Cl-对碳钢的腐蚀作用大于SO42-,使碳钢在盐酸中的腐蚀速率明显快于硫酸,另一方面,随着酸浓度增大,浓硫酸会使钢铁钝化,腐蚀速率减慢,故答案为:酸浓度较低时,


科目:高中化学 来源: 题型:
【题目】锰元素的化合物在多个领域中均有重要应用。
(1)二价锰的3种离子化合物的熔点如表:
物质 | MnCl2 | MnS | MnO |
熔点 | 650℃ | 1610℃ | 2800℃ |
上表3种物质中晶格能最大的是___。
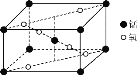
(2)某锰氧化物的晶胞结构如图所示,该氧化物的化学式为___。
(3)与NO3-互为等电子体的一种分子为___(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,3 - 环己二酮( )常用作医药中间体,用于有机合成。下列是一种合成1,3-环己二酮的路线。
)常用作医药中间体,用于有机合成。下列是一种合成1,3-环己二酮的路线。
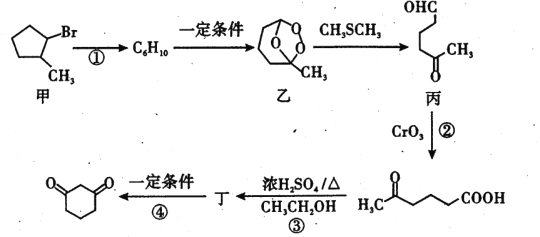
回答下列问题:
(1)甲的分子式为 ___________________。
(2)丙中含有官能团的名称是______________________ 。
(3)反应①的反应类型是 _________ ;反应②的反应类型是 ______________。
(4)反应③的化学方程式为_________________________________。
(5)符合下列条件的乙的同分异构体共有_____________种。
①能发生银镜反应
②能与NaHCO3溶液反应,且 1 mol 乙与足量NaHCO3 溶液反应时产生气体22. 4 L( 标准状况)写出其中在核磁共振氢谱中峰面积之比为 1 : 6 : 2 : 1 的一种同分异构体的结构简式 __________________。(任意一种)
(6)设计以乙醇、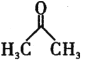 (丙酮)为原料制备
(丙酮)为原料制备![]() (2,4 -戊二酮)的合成路线________________(无机试任选)。
(2,4 -戊二酮)的合成路线________________(无机试任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:A(g)+3B(s)![]() 2C(g)+2D(g),在不同条件下的反应速率如下,其中表示的反应速率最大的是( )
2C(g)+2D(g),在不同条件下的反应速率如下,其中表示的反应速率最大的是( )
A.v(A)=0.5mol·L-1·min-1B.v(B)=1.2mol·L-1·s-1
C.v(D)=0.4mol·L-1·min-1D.v(C)=0.1mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
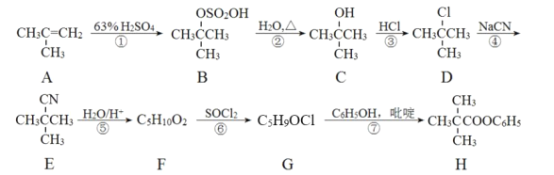
【题目】某化学兴趣小组利用酰卤的醇解制备酯的合成路线如图:
回答下列问题:
(1)A的名称为__(系统命名法),①、⑥的反应类型分别是__、__。
(2)写出②的反应方程式__。
(3)D中官能团的名称是__。
(4)G的结构简式为__。
(5)化合物W与H互为同系物,分子式为C10H12O2,满足以下条件,化合物W的同分异构体有__种,写出其中核磁共振氢谱为5组峰的物质的结构简式___。
a.苯环上有两个取代基 b.遇FeCl3溶液显紫色 c.可以发生银镜反应
(6)写出以甲苯和A为起始原料(其他试剂任选),制备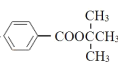 的合成路线:___。
的合成路线:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向0.1molL-1HX溶液中逐渐加入NaOH固体,恢复至原温度后 与pH的关系如图所示(忽略溶液体积变化),下列有关叙述不正确的是
与pH的关系如图所示(忽略溶液体积变化),下列有关叙述不正确的是
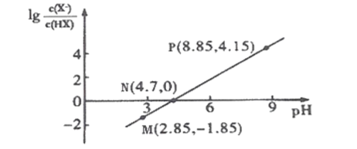
A.HX的Ka的数量级为10-5
B.P 点的溶液中:c(Na+)>c(X-)>c(OH-)>c(H+)
C.N 点的溶液中:c(Na+)+c(H+) = c(HX)+c(OH-)
D.M 点的溶液中:c(Na+)+c(HX) +c(H+) = 0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图所示
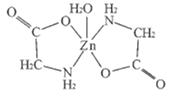
(1)基态Zn2+核外价电子排布图为_____;一水合甘氨酸锌中所涉及的非金属元素电负性由大到小的排列顺序为_____。
(2)甘氨酸(H2N-CH2-COOH)的羧基中C原子的杂化轨道类型为_____;甘氨酸易溶于水,试从结构角度解释:_____。
(3)以氧化锌矿物为原料,提取锌的过程中涉及反应:Zn+2NH3+ 2NH4+= [Zn(NH3)4]2++H2O。与NH4+互为等电子体的阴离子为_____(写岀1种即可);[Zn(NH3)4]2+ 离子结构示意图:____________。
(4) [Zn(IMI)4](ClO4)2是Zn2+的另一种配合物,IMI的结构为![]() ,则1mol IMI中含有_____个σ键;常温下IMI的某种衍生物与甘氨酸形成的离子化合物
,则1mol IMI中含有_____个σ键;常温下IMI的某种衍生物与甘氨酸形成的离子化合物 为液态而非固态,其原因是_____。
为液态而非固态,其原因是_____。
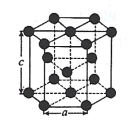
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为 _____;六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,则Zn的密度为_____gcm-3(列出算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中,可由钙在纯氧下加热制得![]() ,反应装置如图所示,关于实验操作或叙述错误的是( )
,反应装置如图所示,关于实验操作或叙述错误的是( )
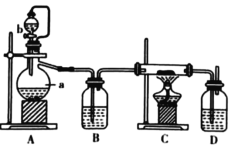
A.若a中装有少量二氧化锰固体,则b中试剂为过氧化氢溶液
B.打开分液漏斗活塞,当A中产生的气体充满整个装置后,再点燃C处酒精灯
C.反应结束后,将装置C中所得固体物质加入过量水中,有无色无味气体生成,说明C中所得固体全部为![]()
D.装置D中装有的浓硫酸可以防止空气中的水蒸气和二氧化碳进入C中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的相对分子质量为128,燃烧只生成CO2和H2O,已知A中含有一个六元碳环且A可与NaHCO3溶液反应,则该有机物碳环上一氯代物的数目为(不考虑立体异构)( )
A.2B.3C.4D.5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com