
ЁОЬтФПЁПФГбЇЩњгУ0.10 molЁЄLЃ1БъзМNaOHШмвКЕЮЖЈФГХЈЖШЕФбЮЫсЁЃМЧТМЪ§ОнШчЯТЃК
ЪЕбщ ађКХ | Д§ВтвК ЬхЛ§/mL | ЫљЯћКФNaOHБъзМвКЕФЬхЛ§/mL | |
ЕЮЖЈЧАЖСЪ§/mL | ЕЮЖЈКѓЖСЪ§/mL | ||
1 | 20.00 | 0.50 | 20.54 |
2 | 20.00 | 6.00 | 26.00 |
3 | 20.00 | 1.40 | 21.36 |

ЃЈ1ЃЉЕЮЖЈЪБбЁгУЗгЬЊЪдвКзїжИЪОМСЃЌШчКЮХаЖЯЕЮЖЈДяЕНжеЕу____________ЁЃ
ЃЈ2ЃЉЕЮЖЈЙ§ГЬжаЃЌблОІгІзЂЪг_____________________ЃЛ
ЃЈ3ЃЉбЮЫсЕФЮяжЪЕФСПХЈЖШЮЊ___________ЁЃ
ЃЈ4ЃЉМюЪНЕЮЖЈЙмМтзьВПЗжгаЦјХнЃЌЕЮЖЈКѓЯћЪЇЃЌЖдВтЖЈНсЙћЕФгАЯьЪЧ__________(ЬюЁАЦЋИпЁБЁАЦЋЕЭЁБЛђЁАЮогАЯьЁБ)ЁЃ
ЃЈ5ЃЉФГЭЌбЇгУвбжЊзМШЗХЈЖШЕФИпУЬЫсМиШмвКЕЮЖЈШмвКжаFe2ЃЋЕФХЈЖШЃЌИпУЬЫсМиШмвКгІЪЂЗХдк________(ЬюЁАМзЁБЛђЁАввЁБ)жаЃЌИУЗДгІЕФРызгЗНГЬЪНЮЊ_______________
ЁОД№АИЁПЕБЕЮШызюКѓвЛЕЮNaOHШмвКЃЌШмвКгЩЮоЩЋБфЮЊЧГКьЩЋЃЌЧвАыЗжжгФкВЛЭЪЩЋЁЃ зЖаЮЦПФкШмвКбеЩЋЕФБфЛЏЃЛ 0.10 molЁЄLЃ1ЁЁ ЦЋИп Мз 5Fe2ЃЋЃЋMnO4-ЃЋ8HЃЋ===5Fe3ЃЋЃЋMn2ЃЋЃЋ4H2O
ЁОНтЮіЁП
ЃЈ1ЃЉбЮЫсЮЊД§ВтвКЃЌЧтбѕЛЏФЦЮЊБъзМвКЃЌжИЪОМСЮЊЗгЬЊЃЌЕЮЖЈжеЕуЮЊЮоЩЋБфЮЊКьЩЋЃЌЧвАыЗжжгВЛБфЩЋЃЌИљОнбЮЫсКЭЧтбѕЛЏФЦЕФЗДгІБШР§НјааМЦЫуЃЛ
ЃЈ2ЃЉИљОнИпУЬЫсМиШмвКОпгаЧПбѕЛЏадЃЌгІгУЫсЪНЕЮЖЈЙмЪЂЗХЗжЮіЃЛ
ЃЈ3ЃЉИљОнЪЕбщЪ§ОнЕФгааЇадНјааДІРэЃЛ
ЃЈ4ЃЉНсКЯВйзїВЛЕБЖдбЮЫсХЈЖШЕФгАЯьЗжЮіЁЃ
(1)зЖаЮЦПжаЮЊбЮЫсКЭЗгЬЊШмвКЃЌЕЮЖЈжеЕуЕФБфЛЏЮЊЃКЕБЕЮШызюКѓвЛЕЮNaOHШмвКЃЌШмвКгЩЮоЩЋБфЮЊЧГКьЩЋЃЌЧвАыЗжжгФкВЛЭЪЩЋЃЛ
(2)дкЕЮЖЈЙ§ГЬжаблОІЙлВьзЖаЮЦПФкШмвКбеЩЋЕФБфЛЏЃЛ
(3)Ш§ДЮЕЮЖЈашвЊЕФЧтбѕЛЏФЦШмвКЕФЬхЛ§ЗжБ№ЮЊЃК20.54-0.50=20.04mLЃЌ,2.00-6.00=20.00 mLЃЌ21.36-1.4=19.96 mLЃЌШ§ДЮЕФЦНОљжЕЮЊ20.00 mLЃЌбЮЫсЕФХЈЖШЮЊ![]() = 0.10 molЁЄLЃ1ЃЛ
= 0.10 molЁЄLЃ1ЃЛ
(4) МюЪНЕЮЖЈЙмМтзьВПЗжгаЦјХнЃЌЕЮЖЈКѓЯћЪЇЃЌдђЧтбѕЛЏФЦШмвКЕФЬхЛ§БфДѓЃЌдђВтЖЈЕФбЮЫсЕФХЈЖШЦЋИпЃЛ
(5) ИпУЬЫсМиШмвКОпгаЧПбѕЛЏадЃЌЫљвдгУЫсЪНЕЮЖЈЙмЪЂЗХЃЌбЁдёМзЃЌИпУЬЫсМиКЭбЧЬњРызгЗДгІЩњГЩЬњРызгКЭУЬРызгКЭЫЎЃЌРызгЗНГЬЪНЮЊЃК5Fe2ЃЋЃЋMnO4-ЃЋ8HЃЋ===5Fe3ЃЋЃЋMn2ЃЋЃЋ4H2OЁЃ


 ЧсЫЩЪюМйзмИДЯАЯЕСаД№АИ
ЧсЫЩЪюМйзмИДЯАЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЬМЕФЕЅжЪЁЂЛЏКЯЮядкЩњВњЩњЛюжагаЙуЗКгІгУЁЃ
ЃЈ1ЃЉЪЏФЋЪЧЬМЕФвЛжжЕЅжЪЁЃ
вбжЊЃК
C(ЪЏФЋ)+![]() O2(g)=CO(g) ЁїH=-110.5kJЁЄmol-1
O2(g)=CO(g) ЁїH=-110.5kJЁЄmol-1
H2(g)+![]() O2(g)=H2O(g) ЁїH=-241.8kJЁЄmol-1
O2(g)=H2O(g) ЁїH=-241.8kJЁЄmol-1
дђC(ЪЏФЋ)+H2O(g)=CO(g)+H2(g)ЁїH=___kJЁЄmol-1
ЂквдЪЏФЋЮЊЕчМЋЕчНтБЅКЭЪГбЮЫЎЃЌбєМЋЕФЕчМЋЗДгІЪНЪЧ___ЁЃ
ЃЈ2ЃЉРћгУCO2ЩњВњМзДМЃК
CO2(g)+3H2(g)=CH3OH(g)+H2O(g) H=-49.0kJЁЄmol-l
ЭљУмБеШнЦїжаГфШыCO2КЭH2ЃЌдквЛЖЈЬѕМўЯТЗДгІЃЌCO2(g)КЭCH3OH(g)ЕФХЈЖШЫцЪБМфБфЛЏШчЭМЫљЪОЁЃ
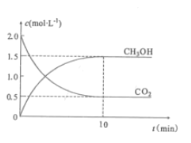
ЂйДгЗДгІПЊЪМЕНЦНКтЃЌЧтЦјЕФЦНОљЗДгІЫйТЪv(H2)=___mol.L-1.min-1ЁЃ
ЂкДяЕНЦНКтКѓЃЌИФБфЯТСаЬѕМўЃЌФмЪЙЛЏбЇЦНКтЯђе§ЗДгІЗНЯђвЦЖЏЕФЪЧ____ЃЈЬюБъКХ)ЁЃ
A.Щ§ИпЮТЖШ B.дйГфШывЛЖЈСПЕФCO2 C.МѕаЁбЙЧП
ЃЈ3ЃЉДзЫсЪЧГЃМћЕФШѕЫсЁЃ
ЂйЭљCH3COOHШмвКжаМгШыЭЌЬхЛ§ЁЂЭЌХЈЖШЕФАБЫЎЛьКЯШмвКЕФЕМЕчад___(ЬюЁАдіЧПЁБЛђЁАМѕШѕЁА)ЁЃ
Ђк25ЁцЪБЃЌЭљCH3COOHШмвКжаМгШыNaOHШмвКЃЌЕБc(CH3COOЃ)=(Na+)ЪБЃЌШмвКpH___7(ЬюЁАЛђЁА<")
ЃЈ4ЃЉЬМЫсФЦЪЧвЛжжживЊЬМЫсбЮЁЃ
ЂйЭљ0.1molЁЄL-1ЕФNa2CO3ШмвКжаЕЮШыМИЕЮЗгЬЊЪдвКЃЌШмвКГЪЯж___ЩЋЃЌдвђЪЧ___(гУРызгЗНГЬЪНБэЪО)ЁЃ
ЂкNa2CO3ШмвКПЩНЋЙјТЏЫЎЙИжаЕФCaSO4зЊЛЏЮЊвзГ§ШЅЕФCaCO3ЃКCaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(ag)ЃЌ25ЁцЪБИУЗДгІЕФЦНКтГЃЪ§ЮЊ___ЁЃ[Ksp(CaCO3)=5.0ЁС10-9ЃЌKsp(CaSO4)=7.1ЁС10-5]
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчЭМЭМЪОгыЖдгІЕФа№ЪіЯрЗћЕФЪЧ![]()
A.ЭММзБэЪОдкКуШнУмБеШнЦїжаЃЌКуЮТЬѕМўЯТЗЂЩњЕФПЩФцЗДгІ![]() ЃЌИїЮяжЪЕФХЈЖШгыЦфЯћКФЫйТЪжЎМфЕФЙиЯЕЃЌЦфжаНЛЕуAЖдгІЕФзДЬЌЮЊЛЏбЇЦНКтзДЬЌ
ЃЌИїЮяжЪЕФХЈЖШгыЦфЯћКФЫйТЪжЎМфЕФЙиЯЕЃЌЦфжаНЛЕуAЖдгІЕФзДЬЌЮЊЛЏбЇЦНКтзДЬЌ
B.ЭМввЧњЯпБэЪОЗДгІ![]() ЃЌе§ЁЂФцЗДгІЕФЦНКтГЃЪ§KЫцЮТЖШЕФБфЛЏ
ЃЌе§ЁЂФцЗДгІЕФЦНКтГЃЪ§KЫцЮТЖШЕФБфЛЏ
C.ЭМБћБэЪОЖдЗДгІ![]() дк
дк![]() ЪБПЬдіДѓбЙЧП
ЪБПЬдіДѓбЙЧП
D.ЭМЖЁБэЪОЗДгІ![]() ЃК
ЃК![]() ЃЛ
ЃЛ![]() ЃЛ
ЃЛ![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПN2O5ЪЧвЛжжаТаЭЯѕЛЏМСЃЌвЛЖЈЮТЖШЯТЗЂЩњ2N2O5(g)![]() 4NO2(g)ЃЋO2(g)ЁЁІЄH>0ЃЌT1ЮТЖШЯТЕФВПЗжЪЕбщЪ§ОнЮЊ
4NO2(g)ЃЋO2(g)ЁЁІЄH>0ЃЌT1ЮТЖШЯТЕФВПЗжЪЕбщЪ§ОнЮЊ
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
ЯТСаЫЕЗЈВЛе§ШЗЕФЪЧЃЈ ЃЉ
A. 500 sФкN2O5ЗжНтЫйТЪЮЊ2.96ЁС10Ѓ3 mol/(LЁЄs)
B. T1ЮТЖШЯТЕФЦНКтГЃЪ§ЮЊK1ЃН125ЃЌ1 000 sЪБзЊЛЏТЪЮЊ50%
C. ЦфЫћЬѕМўВЛБфЪБЃЌT2ЮТЖШЯТЗДгІЕН1 000 sЪБВтЕУN2O5(g)ХЈЖШЮЊ2.98 mol/LЃЌдђT1<T2
D. T1ЮТЖШЯТЕФЦНКтГЃЪ§ЮЊK1ЃЌT2ЮТЖШЯТЕФЦНКтГЃЪ§ЮЊK2ЃЌШєT1>T2ЃЌдђK1>K2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПАДвЊЧѓЬюПеЃК
ЃЈ1ЃЉдкЪвЮТЯТЃЌЕШЬхЛ§ЁЂЕШХЈЖШЕФЧтбѕЛЏФЦгыДзЫсЛьКЯКѓШмвКГЪ__адЃЌШмвКжаc(Na+)__c(CH3COO-)(ЬюЁАЃОЁБЁА=ЁБЛђЁАЃМЁБ)ЃЛpH=13ЕФЧтбѕЛЏФЦгыpH=1ЕФДзЫсЕШЬхЛ§ЛьКЯКѓШмвКГЪ__адЃЌШмвКжаc(Na+)___c(CH3COO-)(ЬюЁАЃОЁБЁА=ЁБЛђЁАЃМЁБ)ЃЛ
ЃЈ2ЃЉЯТСаШмвКЃЌЂй0.1mol/L HClШмвКЂк0.1mol/L H2SO4ШмвКЂл0.1mol/L NaOHШмвКЂм0.1mol/L CH3COOHШмвКЃЌАДpHгЩаЁЕНДѓЫГађЮЊ______________ЁЃ
ЃЈ3ЃЉCuSO4ЕФЫЎШмвКГЪЫсадЕФдвђЪЧЃЈгУРызгЗНГЬЪНБэЪОЃЉЃК____ЃЛЪЕбщЪвдкХфжЦCuSO4ЕФШмвКЪБЃЌГЃНЋCuSO4ЙЬЬхЯШШмгкНЯХЈЕФСђЫсжаЃЌШЛКѓдйгУеєСѓЫЎЯЁЪЭЕНЫљашЕФХЈЖШЃЌвд___ЃЈЬюЁАДйНјЁБЁЂЁАвжжЦЁБЃЉЦфЫЎНтЁЃ
ЃЈ4ЃЉвбжЊЃКФбШмЕчНтжЪCu(OH)2дкГЃЮТЯТЕФKSP=2ЁС10-20ЃЌдђГЃЮТЯТЃКФГCuSO4ШмвКжаcЃЈCu2+ЃЉ=0.02molL-1ЃЌШчвЊЩњГЩCu(OH)2ГСЕэЃЌгІЕїећШмвКЕФpHзюаЁЮЊ____ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛжжЕчЛЏбЇЁАДѓЦјЙЬЬМЁБЕчГиЙЄзїдРэШчЭМЫљЪОЁЃИУЕчГидкГфЕчЪБЃЌЭЈЙ§ДпЛЏМСЕФбЁдёадПижЦЃЌжЛгаLi2CO3ЗЂЩњбѕЛЏЃЌЪЭЗХГіCO2КЭO2ЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ

A.ИУЕчГиЗХЕчЪБЕФе§МЋЗДгІЮЊ2LiЃ2eЃЃЋCO32Ѓ===Li2CO2
B.ИУЕчГиМШПЩбЁгУКЌЫЎЕчНтвКЃЌвВПЩбЁЮоЫЎЕчНтвК
C.ГфЕчЪБбєМЋЗЂЩњЕФЗДгІЮЊCЃЋ2Li2CO3Ѓ4eЃ===3CO2ЃЋ4LiЃЋ
D.ИУЕчГиУПЗХЁЂГф4 molЕчзгвЛДЮЃЌРэТлЩЯФмЙЬЖЈ1 mol CO2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПPCl3ЪЧжЦдьгаЛњСзХЉвЉКЭЛЧАЗрзрЄРрвНвЉЕФдСЯЃЌЦфжЦБИЗНЗЈЪЧНЋШлШкЛЦСз(P4)гыИЩдяТШЦјНјааТШЛЏЗДгІЁЃ
(1) PCl3гіЫЎЛсЧПСвЫЎНтЃЌаДГіPCl3гыЫЎЗДгІЕФЛЏбЇЗНГЬЪНЃК________ЁЃ
(2) жЦЕУЕФPCl3ДжВњЦЗжаГЃКЌгаPOCl3ЁЂPCl5ЕШдгжЪЁЃЭЈЙ§ЪЕбщВтЖЈДжВњЦЗжаPCl3ЕФжЪСПЗжЪ§ЃЌЪЕбщВНжшШчЯТ(ВЛПМТЧдгжЪЕФЗДгІ)ЃК
a. бИЫйвЦШЁ20.00 g PCl3ДжВњЦЗЃЌМгЫЎЭъШЋЫЎНтКѓЃЌдйХфГЩ500.00 mLШмвКЃЛ
b. СПШЁЫљХфШмвК25.00 mLгкЕтСПЦПжаЃЌМгШы0.500 0 molЁЄLЃ1ЕтШмвК20.00 mLКЭ1.000 molЁЄLЃ1(NH4)3BO3ШмвК30.00 mLЃЌеёЕДЃЛ
c. МгШы2ЁЋ3ЕЮЕэЗлШмвКЃЌгУ1.000 0 molЁЄLЃ1 Na2S2O3БъзМШмвКЕЮЖЈЙ§СПЕФЕтЃЌЕЮжСжеЕуЪБЯћКФNa2S2O3БъзМШмвК12.00 mLЁЃ
вбжЊВтЖЈЙ§ГЬжаЕФВПЗжЗДгІЮЊH3PO3ЃЋH2OЃЋI2![]() H3PO4ЃЋ2HIЃЌ3HIЃЋ(NH4)3BO3===3NH4IЃЋH3BO3ЃЌI2ЃЋNa2S2O3ЈDЁњNa2S4O6ЃЋNaI(ЮДХфЦН)ЁЃ
H3PO4ЃЋ2HIЃЌ3HIЃЋ(NH4)3BO3===3NH4IЃЋH3BO3ЃЌI2ЃЋNa2S2O3ЈDЁњNa2S4O6ЃЋNaI(ЮДХфЦН)ЁЃ
ЂйВНжшbжаМгШы(NH4)3BO3ШмвКЕФФПЕФЪЧ________ЁЃ
ЂкХаЖЯВНжшcжаЕЮЖЈжеЕуЕФЗНЗЈЮЊ________ЁЃ
ЂлИљОнЩЯЪіЪ§ОнЃЌМЦЫужЦЕУДжВњЦЗжаPCl3ЕФжЪСПЗжЪ§(аДГіМЦЫуЙ§ГЬ)ЁЃ_________
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛЖЈСПЕФЛьКЯЦјЬхдкУмБеШнЦїжаЗЂЩњШчЯТЗДгІЃК![]() ,ДяЕНЦНКтКѓВтЕУAЦјЬхЕФХЈЖШЮЊ
,ДяЕНЦНКтКѓВтЕУAЦјЬхЕФХЈЖШЮЊ![]() ,БЃГжЮТЖШВЛБф,НЋУмБеШнЦїЕФШнЛ§бЙЫѕЮЊдРДЕФвЛАыдйДЮДяЕНЦНКтКѓ,ВтЕУAХЈЖШЮЊ
,БЃГжЮТЖШВЛБф,НЋУмБеШнЦїЕФШнЛ§бЙЫѕЮЊдРДЕФвЛАыдйДЮДяЕНЦНКтКѓ,ВтЕУAХЈЖШЮЊ![]() ,дђЯТСаа№Ъіе§ШЗЕФЪЧ
,дђЯТСаа№Ъіе§ШЗЕФЪЧ![]()
![]()
A.ЦНКтЯђе§ЗДгІЗНЯђвЦЖЏB.![]()
C.BЕФЮяжЪЕФСПХЈЖШМѕаЁD.CЕФЬхЛ§ЗжЪ§НЕЕЭ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвРОнбѕЛЏЛЙдЗДгІЃК2AgЃЋЃЋCu===Cu2ЃЋЃЋ2AgЃЌЩшМЦЕФдЕчГиШчЯТЭМЫљЪОЁЃ

ЧыЛиД№ЯТСаЮЪЬтЃК
(1)ЕчМЋXЕФВФСЯЪЧ________ЃЛYЪЧ________ЁЃ
(2)вјЕчМЋЮЊЕчГиЕФ________МЋЃЌXЕчМЋЩЯЗЂЩњЕФЕчМЋЗДгІЮЊ_____________________
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com