
【题目】碳的单质、化合物在生产生活中有广泛应用。
(1)石墨是碳的一种单质。
已知:
C(石墨)+![]() O2(g)=CO(g) △H=-110.5kJ·mol-1
O2(g)=CO(g) △H=-110.5kJ·mol-1
H2(g)+![]() O2(g)=H2O(g) △H=-241.8kJ·mol-1
O2(g)=H2O(g) △H=-241.8kJ·mol-1
则C(石墨)+H2O(g)=CO(g)+H2(g)△H=___kJ·mol-1
②以石墨为电极电解饱和食盐水,阳极的电极反应式是___。
(2)利用CO2生产甲醇:
CO2(g)+3H2(g)=CH3OH(g)+H2O(g) H=-49.0kJ·mol-l
往密闭容器中充入CO2和H2,在一定条件下反应,CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
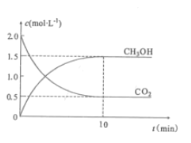
①从反应开始到平衡,氢气的平均反应速率v(H2)=___mol.L-1.min-1。
②达到平衡后,改变下列条件,能使化学平衡向正反应方向移动的是____(填标号)。
A.升高温度 B.再充入一定量的CO2 C.减小压强
(3)醋酸是常见的弱酸。
①往CH3COOH溶液中加入同体积、同浓度的氨水混合溶液的导电性___(填“增强”或“减弱“)。
②25℃时,往CH3COOH溶液中加入NaOH溶液,当c(CH3COO-)=(Na+)时,溶液pH___7(填“或“<")
(4)碳酸钠是一种重要碳酸盐。
①往0.1mol·L-1的Na2CO3溶液中滴入几滴酚酞试液,溶液呈现___色,原因是___(用离子方程式表示)。
②Na2CO3溶液可将锅炉水垢中的CaSO4转化为易除去的CaCO3:CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(ag),25℃时该反应的平衡常数为___。[Ksp(CaCO3)=5.0×10-9,Ksp(CaSO4)=7.1×10-5]
【答案】+131.3 2Cl--2e-=Cl2↑ 0.45 B 增强 = 红 CO32-+H2O![]() HCO3-+OH- 1.42×104
HCO3-+OH- 1.42×104
【解析】
(1)根据C(石墨)、H2燃烧的热化学方程式,利用盖斯定律可写出热化学方程式并求出反应热;阳极上氯离子失电子产生氯气;
(2)①根据CO2和CH3OH(g)的浓度随时间的变化的图示,先根据甲醇的浓度变化计算出消耗的氢气的浓度,再计算出氢气的平均反应速率;
②根据平衡移动原理进行分析;
(3)①弱电解质转为强电解质,导电性增强;
②根据电荷守恒c(CH3COO-)+c(OH-)=(Na+)+c(H+)判断;
(4)①Na2CO3为强碱弱酸盐,水解呈碱性;
②平衡常数K= =
=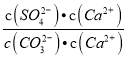 =
=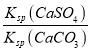 。
。
(1)①C(石墨)+![]() O2(g)=CO(g) △H1=-110.5kJ·mol-1;②H2(g)+
O2(g)=CO(g) △H1=-110.5kJ·mol-1;②H2(g)+![]() O2(g)=H2O(g) △H2=-241.8kJ·mol-1;根据盖斯定律,由①-②得反应C(石墨)+H2O(g)=CO(g)+H2(g) △H=△H1-△H2=-110.5kJ·mol-1-(-241.8kJ·mol-1)=+131.3kJ·mol-1;
O2(g)=H2O(g) △H2=-241.8kJ·mol-1;根据盖斯定律,由①-②得反应C(石墨)+H2O(g)=CO(g)+H2(g) △H=△H1-△H2=-110.5kJ·mol-1-(-241.8kJ·mol-1)=+131.3kJ·mol-1;
②以石墨为电极电解饱和食盐水,阳极上氯离子失电子产生氯气,其电极反应式是2Cl--2e-=Cl2↑;
(2)①根据图示可知,10min达到平衡状态,甲醇浓度为1.5mol/L,由反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g)可知,消耗氢气的浓度为:1.5mol/L×3=4.5mol/L,氢气平均反应速率为:![]() =0.45mol/(Lmin);
=0.45mol/(Lmin);
②反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g) H=-49.0kJ·mol-l为气体体积缩小的放热反应;
A.升高温度,平衡向吸热反应的方向,即向逆反应方向移动,选项A不符合;
B.再充入一定量的CO2,反应物的浓度增大,平衡正向移动,选项B符合;
C.减小压强,平衡向气体体积缩小的方向,即向逆反应方向移动,选项C不符合;
答案选B;
(3)①往CH3COOH溶液中加入同体积、同浓度的氨水,生成醋酸铵为强电解质,混合溶液中离子浓度增大,导电性增强;
②25℃时,往CH3COOH溶液中加入NaOH溶液,当c(CH3COO-)=(Na+)时,根据电荷守恒c(CH3COO-)+c(OH-)=(Na+)+c(H+),因c(CH3COO-)=(Na+),则c(OH-)=c(H+),故溶液pH=7;
(4)①往0.1mol·L-1的Na2CO3溶液中滴入几滴酚酞试液,Na2CO3为强碱弱酸盐,水解呈碱性:CO32-+H2O![]() HCO3-+OH-,溶液呈现红色;
HCO3-+OH-,溶液呈现红色;
②25℃时,反应CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(ag)的平衡常数K= =
=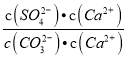 =
= =
=![]() =1.42×104。
=1.42×104。


科目:高中化学 来源: 题型:
【题目】![]() ,向5L恒容密闭容器中充入
,向5L恒容密闭容器中充入![]() 气体,发生反应
气体,发生反应![]() ,一段时间后达到平衡,测得此过程中从外界共吸收了
,一段时间后达到平衡,测得此过程中从外界共吸收了![]() 的热量.当温度度不变时,改变某一条件,下列结论正确的是
的热量.当温度度不变时,改变某一条件,下列结论正确的是![]()
条件改变 | 结论 | |
A | 平衡后向容器中充入1molHe | 平衡常数不变,混合气体的密度也不变 |
B | 起始时向容器中充入 | 反应达到平衡前 |
C | 起始时向容器中充入 | 达到平衡时共放出 |
D | 起始时向容器中充入 | 达到平衡时, |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应:![]() 的数据如图所示。下列说法正确的是( )
的数据如图所示。下列说法正确的是( )
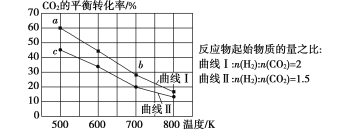
A.该反应的![]()
B.达到平衡时,![]()
C.b点对应的平衡常数K值大于c点
D.a点对应的![]() 的平衡转化率为90%
的平衡转化率为90%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型的乙醇电池(DEFC)是用磺酸类质子溶剂作电解质,在 200℃左右时供电( 如 下 图 所 示 ), 比 甲 醇 电 池 效 率 高 出 32 倍 , 且 比 较 安 全 。 电 池 总 反 应 为C2H5OH+3O2==2CO2+3H2O。则下列说法正确的是( )
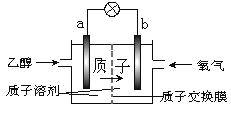
A.a 极为电池的正极
B.电池正极的电极反应:O2 + 4H+ + 4e- = 2H2O
C.电池工作时电子由 b 极沿导线经灯泡再到 a 极
D.溶液中 H+ 向 a 电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) ΔH=-41kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8kJ |
② | 0 | 0 | 1 | 4 | 热量变化:QkJ |
下列说法中,不正确的是( )
A.容器①中反应达平衡时,CO的转化率为80%
B.容器①中CO的转化率等于容器②中CO2的转化率
C.平衡时,两容器中CO2的浓度相等
D.容器①时CO的反应速率等于H2O的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用粗CuO制备CuCl2晶体的流程如下:
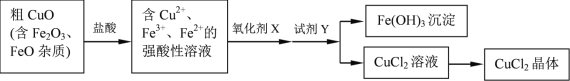
各种离子相关数据如下:
Fe2+ | Cu2+ | Fe3+ | |
开始转化成氢氧化物沉淀时的pH | 7.0 | 4.7 | 1.9 |
完全转化成氢氧化物沉淀时的pH | 9.0 | 6.7 | 3.2 |
请回答:
(1)CuO溶于盐酸的离子方程式是_______________。
(2)已知NaClO为强氧化剂,能将Fe2+氧化为Fe3+。
① NaClO溶液显_______性(填“酸”或“碱”)。你认为用NaClO作氧化剂X是否妥当__________(填“是”或“否”),理由是__________。
②下列另有几种常用的氧化剂,可用作氧化剂X的是__________。
a 浓H2SO4 b C12 c H2O2
(3)试剂Y的作用是调节溶液的pH=3.2,将Fe3+转化为Fe(OH)3沉淀,过滤后得到CuCl2溶液。下列试剂中适宜的是___________。
a NaOH b Na2CO3 c CuCO3 d CuO
(4)为了得到符合质量标准的CuCl2溶液,必须控制溶液的pH____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下在密闭容器中发生如下可逆反应:2M(g)+N(g)![]() 2E(g),若开始时只充入2mol E(g),达平衡时,E的转化率为40%;若开始时充入2mol M和1mol N的混合气体,达平衡时混合气体的压强比起始时减少了( )
2E(g),若开始时只充入2mol E(g),达平衡时,E的转化率为40%;若开始时充入2mol M和1mol N的混合气体,达平衡时混合气体的压强比起始时减少了( )
A.20%B.40%C.60%D.80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.10 mol·L-1标准NaOH溶液滴定某浓度的盐酸。记录数据如下:
实验 序号 | 待测液 体积/mL | 所消耗NaOH标准液的体积/mL | |
滴定前读数/mL | 滴定后读数/mL | ||
1 | 20.00 | 0.50 | 20.54 |
2 | 20.00 | 6.00 | 26.00 |
3 | 20.00 | 1.40 | 21.36 |

(1)滴定时选用酚酞试液作指示剂,如何判断滴定达到终点____________。
(2)滴定过程中,眼睛应注视_____________________;
(3)盐酸的物质的量浓度为___________。
(4)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是__________(填“偏高”“偏低”或“无影响”)。
(5)某同学用已知准确浓度的高锰酸钾溶液滴定溶液中Fe2+的浓度,高锰酸钾溶液应盛放在________(填“甲”或“乙”)中,该反应的离子方程式为_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com