
����Ŀ��һ�����͵��Ҵ���أ�DEFC�����û����������ܼ�������ʣ��� 200������ʱ���磨 �� �� ͼ �� ʾ ���� �� �� �� �� �� Ч �� �� �� 32 �� �� �� �� �� �� ȫ �� �� �� �� �� Ӧ ΪC2H5OH+3O2==2CO2+3H2O��������˵����ȷ���ǣ� ��
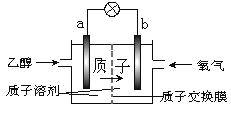
A.a ��Ϊ��ص�����
B.��������ĵ缫��Ӧ��O2 + 4H+ + 4e- = 2H2O
C.��ع���ʱ������ b ���ص��߾������ٵ� a ��
D.��Һ�� H+ �� a �缫�ƶ�
���𰸡�B
��������
�����ӵĶ����ƶ���֪aΪ������bΪ��������������������Ӧ���Ҵ�����������CO2�ͣ��缫��ӦʽΪC2H5OH+3H2O-12e-=2CO2+12H+�����������õ����ӱ���ԭ���缫��ӦʽΪ4H++O2+4e-=2H2O����ϵ缫��Ӧ�����⡣
A�����������ƶ�����֪��a�Ǹ�����b����������A����
B�������������õ��Ӻ������ӷ�Ӧ����ˮ���缫��ӦʽΪ4H++O2+4e-=2H2O����B��ȷ��
C��a�Ǹ�����b��������������ʧ���ӷ���������Ӧ�������ϵõ��ӷ�����ԭ��Ӧ������ӴӸ����ص���������������C����
D����ع���ʱ����Һ�� H+����������b�缫�ƶ�����D����
�ʴ�ΪA��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ�ֺܺõ�ȼ�ϣ���ҵ����һ�������¿����÷�ӦI��II���Ʊ���
��1����֪��25��C��101kPa�£�1g�״�ȼ������CO2��Һ̬ˮʱ����22.68kJ�����ʾȼ���ȵ��Ȼ�ѧ����ʽΪ___
��2����1.0molCH4��2.0molH2O��g��ͨ���ݻ�Ϊ10L�ܱ������У�CH4��g��+H2O��g��CO��g��+3H2��g����I��CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��

�ٸ÷�Ӧ����H__0����S__0����������������������=������
����֪100��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ��ƽ����Ӧ����Ϊ___���÷�Ӧ��ƽ�ⳣ��Ϊ___(mol��L-1)2��
��3����ѹǿΪ0.1MPa�����£�amolCO��3amolH2�Ļ�������ڴ������������Է���Ӧ���ɼ״���CO��g��+2H2��g��CH3OH��g����H��0�������������ݻ����䣬���д�ʩ������״����ʵ���___������ţ���
A�������¶� B����CH3OH��g������ϵ�з������
C�������³���He��ʹ��ϵ����ѹǿ���� D���ٳ���amolCO��3amolH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������̶��ݻ���Ϊ1L�ܱ��������Բ�ͬ����̼��![]() ����
����![]() ��
��![]() ����һ�������·�����Ӧ��
����һ�������·�����Ӧ��![]()
![]() ��ƽ��ת����
��ƽ��ת����![]() ���¶ȵĹ�ϵ��ͼ��ʾ������˵����ȷ����
���¶ȵĹ�ϵ��ͼ��ʾ������˵����ȷ����![]()
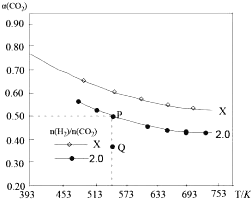
A.�÷�Ӧ�ڸ������Է�����
B.X����̼��![]() ����Q������̼��Ϊ
����Q������̼��Ϊ![]() ʱ
ʱ![]()
C.����ʼʱ��![]() ��
��![]() Ũ�ȷֱ�Ϊ
Ũ�ȷֱ�Ϊ![]() ��
��![]() ����ɵõ�P�㣬��Ӧ�¶ȵ�ƽ�ⳣ����ֵΪ512
����ɵõ�P�㣬��Ӧ�¶ȵ�ƽ�ⳣ����ֵΪ512
D.����P��״̬�������У���2��4��1��4�ı����ٳ���![]() ��
��![]() ��
��![]() ��
��![]() ���ٴ�ƽ���
���ٴ�ƽ���![]() ��С
��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£����ݻ�Ϊ2L���ܱ������У���2mol����M��3molN�����ϣ��������·�Ӧ��![]()
![]() ���÷�Ӧ��ƽ��ʱ������
���÷�Ӧ��ƽ��ʱ������![]() R�������Q��Ũ��Ϊ
R�������Q��Ũ��Ϊ![]() �������й�������ȷ����
�������й�������ȷ����![]()
A.xֵΪ2B.���������ܶ�����
C.ƽ��ʱN��Ũ��Ϊ![]()
![]() D.N��ת����Ϊ
D.N��ת����Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Mn2O3��һ����Ҫ�Ĺ�ҵԭ�ϣ��ڵ�ź��л��ϳɵ�����Ӧ�ù㷺��ijѧϰС����ʵ������CH4��ԭMnO2�Ʊ�Mn2O3�����ⶨ��Ʒ���ȡ���ش��������⣺
��.�Ʊ�(ʵ��װ����ͼ��ʾ)

��֪��Al4C3+12H2O==4Al(OH)3+3CH4����
(1)����a������Ϊ______________________
(2)���Ӻ�ʵ��װ�ã�����װ�õ������Բ�������Ӧ�Լ�������ƿ�еμ�ϡ����֮���ڵ�ȼ�ƾ���֮ǰӦ���еIJ�����____
(3)����b��ͬʱ���������ܲ������ѭ�������ʣ��÷�Ӧ�Ļ�ѧ����ʽΪ_______
��.�ⶨ��Ʒ��Mn2O3�Ĵ���(ֻ���Dz�Ʒ�л�������δ���뷴Ӧ��MnO2)
��.ʵ�������ȡ����b�����ù���7.19g���������������ữ��KI��Һ��ʹ��������Ԫ��ȫ��ת��ΪMn2+�������袡�з�����Ӧ�����ӷ���ʽΪ��Mn2O3+2I- +6H+==2Mn2++ I2+ 3H2O MnO2+2I- + 4H+==Mn2++ I2+ 2H2O ��
��.��������Һϡ����500mL��
��.ȡ25.00mLϡ�ͺ����Һ���μӼ��ε�����Һ����0.200molL-1��Na2S2O3����Һ�ζ����ﵽ�ζ��յ�ʱ������25.00mLNa2S2O3����Һ��
(��֪��I2+2 Na2S2O3==Na2S4O6+2NaI)
(4)�ζ��յ�ı�־��__________________________
(5)��ȡ������Mn2O3����������Ϊ___________________(��������ȷ��0.1��)
(6)���в���ʹ�ⶨ���ƫ�ߵ���______________
A.�ζ�ǰƽ�ӣ��ζ��յ㸩�Ӷ���
B.ʢ��Na2S2O3����Һ�ĵζ���δ�ñ�Һ��ϴ
C.�����ữ��KI��Һ�ڿ����о���ʱ�����
D.�ζ�ǰ�������ζ���ζ��ܼ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ת��������������ԭ��Ӧ�ص���
A. ��̫���ܵ�� | B. ����ӵ�طŵ� | C. �����ȼ��ȼ�� | D. �������ṩ���� |
|
|
|
|
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼�ĵ��ʡ��������������������й㷺Ӧ�á�
��1��ʯī��̼��һ�ֵ��ʡ�
��֪��
C(ʯī)+![]() O2(g)=CO(g) ��H=-110.5kJ��mol-1
O2(g)=CO(g) ��H=-110.5kJ��mol-1
H2(g)+![]() O2(g)=H2O(g) ��H=-241.8kJ��mol-1
O2(g)=H2O(g) ��H=-241.8kJ��mol-1
��C(ʯī)+H2O(g)=CO(g)+H2(g)��H=___kJ��mol-1
����ʯīΪ�缫��ⱥ��ʳ��ˮ�������ĵ缫��Ӧʽ��___��
��2������CO2�����״���
CO2(g)+3H2(g)=CH3OH(g)+H2O(g) H=-49.0kJ��mol-l
���ܱ������г���CO2��H2����һ�������·�Ӧ��CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
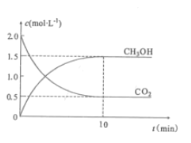
�ٴӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)=___mol.L-1.min-1��
�ڴﵽƽ��ı�������������ʹ��ѧƽ��������Ӧ�����ƶ�����____������)��
A.�����¶� B.�ٳ���һ������CO2 C.��Сѹǿ
��3�������dz��������ᡣ
����CH3COOH��Һ�м���ͬ�����ͬŨ�ȵİ�ˮ�����Һ�ĵ�����___(������ǿ������������)��
��25��ʱ����CH3COOH��Һ�м���NaOH��Һ����c(CH3COO��)=(Na+)ʱ����ҺpH___7(��������<")
��4��̼������һ����Ҫ̼���Ρ�
����0.1mol��L-1��Na2CO3��Һ�е��뼸�η�̪��Һ����Һ����___ɫ��ԭ����___(�����ӷ���ʽ��ʾ)��
��Na2CO3��Һ�ɽ���¯ˮ���е�CaSO4ת��Ϊ�׳�ȥ��CaCO3��CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(ag)��25��ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ___��[Ksp(CaCO3)=5.0��10-9��Ksp(CaSO4)=7.1��10-5]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��t ��ʱ�����ݻ�������ܱ������з�����ӦX(g)��3Y(g) ![]() 2Z(g)��������ڲ�ͬʱ�̵�Ũ�������ʾ������˵����ȷ����(����)
2Z(g)��������ڲ�ͬʱ�̵�Ũ�������ʾ������˵����ȷ����(����)
���� | X | Y | Z |
��ʼŨ��/(mol��L��1) | 0.1 | 0.2 | 0 |
2 minʱŨ��/(mol��L��1) | 0.08 | a | b |
ƽ��Ũ��/(mol��L��1) | 0.05 | 0.05 | 0.1 |
A.ƽ��ʱ��X��ת����Ϊ20%
B.t ��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ40
C.ƽ���������ϵѹǿ��v������v����С��ƽ��������Ӧ�����ƶ�
D.ǰ2 min�ڣ���Y�ı仯����ʾ��ƽ����Ӧ����v(Y)��0.03 mol��L��1��min��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2O5��һ��������������һ���¶��·���2N2O5(g)![]() 4NO2(g)��O2(g)����H>0��T1�¶��µIJ���ʵ������Ϊ
4NO2(g)��O2(g)����H>0��T1�¶��µIJ���ʵ������Ϊ
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
����˵������ȷ������ ��
A. 500 s��N2O5�ֽ�����Ϊ2.96��10��3 mol/(L��s)
B. T1�¶��µ�ƽ�ⳣ��ΪK1��125��1 000 sʱת����Ϊ50%
C. ������������ʱ��T2�¶��·�Ӧ��1 000 sʱ���N2O5(g)Ũ��Ϊ2.98 mol/L����T1<T2
D. T1�¶��µ�ƽ�ⳣ��ΪK1��T2�¶��µ�ƽ�ⳣ��ΪK2����T1>T2����K1>K2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com